ELEMENTOS DE LOS GRUPOS IVA, VA, VIA, VIIA
INTRODUCCIÓN
Es una herramienta fundamental para el estudio de la química pues permite conocer
las semejanzas entre diferentes elementos y comprender qué puede resultar de las
diferentes uniones entre los mismos.
Según se advierte al investigar sobre la tabla periódica, la historia de esta estructura
está relacionada al descubrimiento de los diferentes elementos químicos y a la necesidad de ordenarlos de alguna manera.
Desde los comienzos de la ciencia se intenta comprender el por qué y el cómo de la
materia y los elementos que conforman nuestro sistema. Gracias a las diferentes
experiencias de los científicos cada vez se ha posición descomponer aún más la
materia para analizarla palmo a palmo, llegando finalmente a averiguar que es mucho más compleja de lo que parece.
La Tabla Periódica de los Elementos se divide en grupos, los cuales están conformados por elementos que cumplen ciertas características similares. En esta ocasión se describirán los elementos que conforman los grupos IVA, VA, VIA, VIIA: su origen, sus usos, sus compuestos destacados, y aplicabilidad en materiales de construcción.
OBJETIVOS
- Dar a conocer los elementos pertenecientes a los grupos IVA, VA, VIA, VIIA de la tabla periódica, estudiando a fondo sus propiedades y aplicaciones.
- Concientizar acerca de los agentes contaminantes que se encuentran es este sector de la tabla periódica, de qué manera afectan al medio ambiente.
GRUPO VllA DE LA TABLA PERIÓDICA

Propiedades generales del grupo VIIA:
Los elementos del grupo VIIA también llamados halógenos por ser todos formadores de sales. Tienen siete electrones en el último nivel y son todos no metales.
Tienen las energías de ionización más elevadas y en consecuencia son los elementos más electronegativos.
Reaccionan fácilmente con los metales formando sales, rara vez están libres en la naturaleza, todos son gaseosos a temperatura ambiente menos el bromo que es líquido en condiciones ambientales normales.
Su característica química más fundamental es su capacidad oxidante porque arrebatan electrones de carga y moléculas negativas a otros elementos para formar aniones.
- Nombres y símbolos de cada elemento del grupo:
Cloro (Cl)
Flúor (F)
Bromo (Br)
Yodo (I)
Astato (At)
- Propiedades físicas y químicas de los elementos más importantes del grupo
VIIA:
Flúor (F): Sus derivados tienen mucho uso industrial. Entre ellos se destaca el
freón utilizado como congelante y la resina teflón. Se agregan además
fluoruros al agua potable y detríticos para prevenir las caries.
Cloro (Cl): Sus propiedades blanqueadoras lo hacen muy útil en las papeleras e industrias textiles. Como desinfectante se agrega al agua en el proceso de potabilización y a las piscinas. Otros usos son las industrias de colorantes y la elaboración de ciertas medicinas.
Bromo (Br): Los bromuros como sedantes. El bromuro de plata en las placas fotográficas.
Yodo (Y): Es esencial en el cuerpo humano para el adecuado funcionamiento de la tiroides por eso se suele agregar a la sal de mesa. También se emplea como antiséptico.
- Origen, ubicación y efectos ambientales sobre el agua, aire o suelo de dichos elementos o sus compuestos:
- fluor:
Descubridor: Henri Moissan.
- Lugar de descubrimiento: Francia.
- Año de descubrimiento: 1886.
Origen del nombre: De la palabra latina "fluere", que significa "fluir".
- Efecto ambiental: En el medio ambiente el flúor no puede ser destruído; solamente puede cambiar de forma. El flúor que se encuentra en el suelo puede acumularse en las plantas. La cantidad de flúor que tomen las plantas depende del tipo de planta, del tipo de suelo y de la cantidad y tipo de flúor
que se encuentre en el suelo. En las plantas que son sensibles a la exposición del flúor incluso bajas concentraciones de flúor pueden provocar daños en las hojas y una disminución del crecimiento.
- cloro:

- Descubridor: Carl Wilhelm Scheele
- Lugar de descubrimiento: Suecia.
- Año de descubrimiento: 1774.
- Origen del nombre: De la palabra griega "chloros", que significa "verde pálido", reflejando el color del gas.
- Efecto ambiental: El cloro se disuelve cuando se mezcla con el agua. También puede escaparse del agua e incorporarse al aire bajo ciertas condiciones. La mayoría de las emisiones de cloro al medio ambiente son al aire y a las aguas superficiales. Una vez en el aire o en el agua, el cloro reacciona con otros compuestos químicos. Se combina con material inorgánico en el agua para formar sales de cloro, y con materia orgánica para formar compuestos orgánicos clorinados.
- bromo:
- Descubridor: Antoine J. Balard.
- Lugar de descubrimiento: Francia.
- Año de descubrimiento: 1826.
- Origen del nombre: De la palabra griega "brómos" que significa "fetidez", debido al fuerte y desagradable olor de este elemento, sobre todo de sus vapores.
- Efecto Ambiental: Los bromuros orgánicos son a menudo aplicados como agentes desinfectantes y protectores, debido a sus efectos perjudiciales para los microorganismos. Cuando se aplican en invernaderos y en campos de cultivo pueden ser arrastrados fácilmente hasta las aguas superficiales, lo que tiene efectos muy negativos para la salud de las daphnia, peces, langostas y algas.
Los bromuros orgánicos son también perjudiciales para los mamíferos, especialmente cuando se acumulan en los cuerpos de sus presas. Los efectos más importantes sobre los animales son daños nerviosos y daños en el ADN, lo que puede aumentar las probabilidades de desarrollar cáncer. Los bromuros orgánicos no son muy biodegradables; cuando son descompuestos se forman bromuros inorgánicos. Éstos pueden dañar el sistema nervioso si son absorbidos en grandes dosis.
- yodo:
Descubridor: Bernard Courtois.
- Lugar de descubrimiento: Francia.
- Año de descubrimiento: 1811.
- Origen del nombre: De la palabra griega "iodes" que significa "violeta", aludiendo al color de los vapores del yodo.
Efecto ambiental: El yodo puede ser radioactivo. Los isótopos radioactivos se forman de manera natural durante reacciones químicas en la atmósfera. La mayoría de los isótopos radioactivos del yodo tienen unas vidas medias muy cortas y se transformarán rápidamente en compuestos estables de yodo. Sin embargo, hay una forma radioactiva del yodo que tiene una vida media de millones de años y que es seriamente perjudicial para el medio ambiente. Este isótopo entra en el aire desde las plantas de energía nuclear, donde se forma durante el procesamiento del uranio y el plutonio. Los accidentes en las plantas nucleares han provocado la emisión de grandes cantidades de yodo radioactivo al aire.
GRUPO VlA DE LA TABLA PERIÓDICA
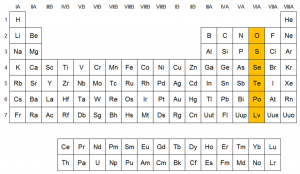
El Grupo VIA recibe también el nombre de Grupo del Oxígeno por ser este el primer elemento del grupo. Tienen seis electrones en el último nivel con la configuración electrónica externa ns2 np4. Los tres primeros elementos, el oxígeno, azufre y selenio son no metales y los dos últimos el telurio y polonio son metaloides.
Grupo del Oxígeno
El grupo VIA del sistema Periódico o grupo del oxígeno está formado por los elementos: oxígeno, azufre, selenio, telurio, polonio. Por encontrarse en el extremo derecho de la Tabla Periódica es fundamentalmente no-metálico; aunque, el carácter metálico aumenta al descender en el grupo. Como en todos los grupos, el primer elemento, el oxígeno, presenta un comportamiento anómalo, ya que al no tener orbitales d en la capa de valencia, sólo puede formar dos enlaces covalentes simples o uno doble, mientras que los restantes elementos pueden formar 2, 4 y 6 enlaces covalentes.
Propiedades atómicas
- La configuración electrónica de los átomos de los elementos del grupo VIA en la capa de valencia es: ns2 np2+1+1. El oxígeno, cabeza de grupo, presenta, igual que en el caso del flúor, unas características particulares que le diferencian del resto (Principio de singularidad). Posibles formas de actuación:
- El oxígeno es un gas diatómico. El azufre y el selenio forman moléculas octaatómicas S8 y Se8
- El telurio y el polonio tienen estructuras tridimensionales.
- El oxígeno, azufre, selenio y telurio tienden a aceptar dos electrones formando compuestos iónicos. Estos elementos también pueden formar compuestos moleculares con otros no metales, en especial el oxígeno.
- El polonio es un elemento radioactivo, difícil de estudiar en el laboratorio.
- Pérdida de electrones
- El alto valor de los potenciales de ionización, pero sobre todo el alto poder polarizarte de sus cationes (debido a su pequeño tamaño) hacen que sólo el polonio dé lugar a sales . Sin embargo, sí que se conocen sales de cationes poliatómicos.
Ganancia de electrones
Pueden actuar como aniones dinegativos, -2 , nunca mononegativos, ya que la mayor energía de red de los compuestos resultantes compensa el valor desfavorable de la electroafinidad. Dado que el tamaño del anión -2 crece conforme se desciende en el grupo, también lo hace su polarizabilidad, de modo que los sulfuros, seleniuros y telururos poseen un marcado carácter covalente que aumenta en dicho sentido. Se conocen también polianiones Eln2-.
Compartición de los electrones
Caben dos posibilidades:
- Formación de dos enlaces σ sencillos.
- Formación de un enlace doble σ + π.
El segundo caso sólo se da cuando los dos átomos implicados son de pequeño tamaño (o en todo caso uno de ellos de tamaño moderado), ya que la eficacia de los solapamientos laterales de orbitales (enlaces π) decrece muy rápidamente conforme aumenta la distancia internuclear, mientras que la eficacia del solapamiento frontal σ, lo hace más lentamente.
Capa de valencia
La presencia de pares electrónicos sin compartir en la capa de valencia permite la formación de, al menos, un tercer enlace covalente dativo. Además, la presencia de pares de electrones no compartidos puede influir en la fortaleza del enlace.
Debilitando el enlace con otros átomos que presenten también pares electrónicos de no enlace.
Fortaleciendo el enlace con átomos que dispongan de orbitales vacantes de energía adecuada.
Salvo el cabeza de grupo, pueden ampliar su octeto, actuando como hipervalentes.
En estos casos es frecuente la formación de enlaces múltiples, ya que la disposición espacial de los orbitales d permite un buen solapamiento pπ-dπ a distancias en las que el solapamiento pπ-pπ sería despreciable. Además pueden utilizar los orbitales nd vacantes, estabilizados por la unión a átomos muy electronegativos, para actuar como ácidos de Lewis.
Estado natural
- Oxígeno (O)
El oxígeno es el elemento más abundante en el planeta tierra. Existe en estado libre, como O2, en la atmósfera (21% en volumen), pero también combinado en el agua y formando parte diversos óxidos y oxosales, como silicatos, carbonatos, sulfatos, etc. En condiciones ordinarias el oxígeno se presenta en dos formas alotrópicas, el dioxígeno y el ozono, de los cuales sólo el primero es termodinámicamente estable. A diferencia del oxígeno, que se presenta en su variedad más estable como molécula diatómica O2 derivada de un enlace doble, los demás presentan estructuras derivadas de enlaces sencillos. Esto es debido a la disminución de la eficacia del solapamiento lateral a medida que aumenta el tamaño de el.

Obtención
- Oxígeno (O2)
Industrialmente, se obtiene de la destilación fraccionada del aire líquido. A escala de laboratorio, existen diversos métodos de obtención:
1) Electrólisis de disoluciones acuosas alcalinas.
2) Descomposición catalítica de H2O2.
3) Descomposición térmica de cloratos.
- Azufre (S)

El azufre se encuentra: nativo (en zonas volcánicas y en domos de sal) ó combinado, en sulfatos, sulfuros (sobre todo pirita, FeS2) y sulfuro de hidrógeno (acompañando al petróleo).
Variedades alotrópicas y sus propiedades físicas:
- En estado sólido: Variedades rómbica y monoclínica (anillos S8), azufre plástico (cadenas Sn).
En estado líquido: Anillos S8 y cadenas de longitud variable.
- En fase gas: Cicloazufre, cadenas Sn (n = 3-10), S2
- selenio:
El selenio presenta tres formas alotrópicas:
- Se rojo: constituido por moléculas Se8.
- Se negro: anillos Sen con n muy grande y variable (forma amorfa).
- Se gris: de estructura similar a la del azufre plástico. Este alótropo presenta
aspecto metálico (es un semimetal) y es fotoconductor.

- Teluro (Te)
Presenta una única variedad alotrópica, el Te gris, similar al Se gris. Tiene un carácter más metálico que el anterior.

- polonio:
Presenta dos alótropos: cúbico simple y romboédrico, en los que cada átomo está directamente rodeado por seis vecinos a distancias iguales (d0=355pm). Ambos alótropos tienen carácter metálico.

Carácter metálico en el grupo
Los elementos de este grupo muestran una transición paulatina desde las propiedades típicamente covalentes en la parte alta del grupo hasta las típicamente metálicas del elemento más pesado; y constituyen un excelente ejemplo de como los modelos de enlace covalente y metálico son, únicamente, casos extremos imaginarios de una situación real más compleja de interpretar. Este aumento se pone de manifiesto no solo en la variación progresiva de sus propiedades físicas y
químicas sino también en cambios en sus estructuras.
Reactividad
- Oxígeno
- Reactividad con los principales elementos de la tabla periódica.
- Relación entre reactividad y estructura del elemento.
Ozono
Mayor reactividad del ozono, tanto desde el punto de vista termodinámico como cinético. La gran diferencia de reactividad entre los dos alótropos del oxígeno pone de manifiesto que las propiedades químicas dependen del estado elemental.
Resto del grupo
La reactividad del resto de los calcógenos va siendo cada vez menor a medida que descendemos en el grupo.
Reactividad con elementos y compuestos.
Reactividad en disolución acuosa: se comportan como oxidantes bastante buenos debido a la general insolubilidad de los calcogenuros, que retiran de inmediato iones. El2- del medio, favoreciendo la reacción. También se pueden comportar como reductores, pasando a estados de oxidación formal positivos.
Aplicaciones
Los elementos del grupo vi a, conocidos como la familia del grupo del oxígeno, comprenden al oxigeno (o), azufre (s), selenio (se), telurio (te) y polonio (po). aunque todos ellos tienen seis electrones de valencia, sus propiedades varían de no metálicas a metálicas en cierto grado, conforme aumenta el numero atómico.
- Oxígeno: Como oxígeno molecular (O2 ) se utiliza en la industria del acero, en el tratamiento de aguas negras, en el blanqueado de pulpa y papel, en sopletes oxiacetilénicos, en medicina y en numerosas reacciones como agente oxidante.
El oxigeno gaseoso, O2 es fundamental para la vida; es necesario para quemar los combustibles fósiles y obtener así energía, y se requiere durante el metabolismo urbano para quemar carbohidratos. en ambos procesos, los productos secundarios son dióxido de carbono y agua. El oxigeno constituye
el 21 % en volumen del aire y el 49.5 % en peso de la corteza terrestre. La otro forma alotrópica del oxigeno es el ozono, cuya fórmula es o3 es mas reactivo que el oxigeno ordinario y se puede formar a partir de oxigeno en un arco eléctrico, como el descargador a distancia de un motor eléctrico, también
se puede producir ozono por la acción de la luz ultravioleta sobre el oxigeno; esto explica el aroma " fresco del aire durante las tormentas eléctricas".
- Azufre: El azufre es el segundo elemento no metal del grupo. a temperatura ambiente es un sólido amarillo pálido que se encuentra libre en la naturaleza. lo conocían los antiguos y se le menciona en el libro del génesis como piedra de azufre. las moléculas de azufre contienen ocho átomos de azufre
conectados a un anillo; su fórmula es s8 . el azufre tiene una importancia especial en la manufactura de neumáticos de hule y acido sulfúrico, H2SO4 . Otros compuestos de azufre son importantes para blanquear frutos y granos Se usa en muchos procesos industriales como la producción de ácido sulfúrico (sustancia química más importante a nivel industrial), en la fabricación de pólvora y el vulcanizado del caucho. Algunos compuestos como los sulfitos tienen propiedades blanqueadoras, otros tienen uso medicinal (sulfas, sulfato de magnesio). También se utiliza en la elaboración de fertilizantes y como fungicida.
-Selenio: El selenio es un no metal que presenta interesantes propiedades y usos. la conductividad de este elemento aumenta con la intensidad de la luz. a causa de esta fotoconductividad, el selenio se a utilizado en los medidores de luz para camaras fotograficas y en fotocopiadoras, pero la preocupación que origina su toxicidad ha hecho que disminuya su uso. el selenio tambien puede convertir la corriente electrica alterna en corriente directa; se ha utilizado en rectificadores, como los convertidores que se usan en los radios y grabadores portátiles, y en herramientas electricas recargables. el color rojo que el selenio imparte al vidrio lo hace util en la fabricación de lentes para señales luminosas.
Se utiliza básicamente en electricidad y electrónica, como en células solares y rectificadores. Se añade a los aceros inoxidables y es catalizador de reacciones de deshidrogenación. Algunos compuestos se emplean en la fabricación del vidrio y esmaltes. Los sulfuros se usan en medicina veterinaria y champús. El dióxido de selenio es un catalizador muy utilizado en reacciones de oxidación, hidrogenación y deshidrogenación de compuesos orgánicos.
- Telurio: El telurio, tiene aspecto metalico, pero es un metaloide en el que predominan las propiedades no metalicas. se emplea en semiconductores y para endurecer las placas de los acumuladores de plomo y el hierro colado. se presenta en la naturaleza en diversos compuestos, pero no es abundante. el polonio es un elemento radiactivo poco comun que emite radiación alfa y
gama; su manejo es muy peligroso. los usos de este elemento se relacionan con su radiactividad, y fue descubierto por marie curie, quien le dio este nombre en honor a su natal polonia.
Se emplea para aumentar la resistencia a la tensión en aleaciones de cobre y plomo y en la fabricación de dispositivos termoeléctricos. También se utiliza como agente vulcanizador y en la industria del vidrio. El telurio coloidal es insecticida y fungicida.
- Polonio: los isótopos constituyen una fuente de radiación alfa. Se usan en la investigación nuclear. Otro uso es en dispositivos ionizadores del aire para eliminar la acumulación de cargas electrostáticas.
GRUPO VA DE LA TABLA PERIÓDICA
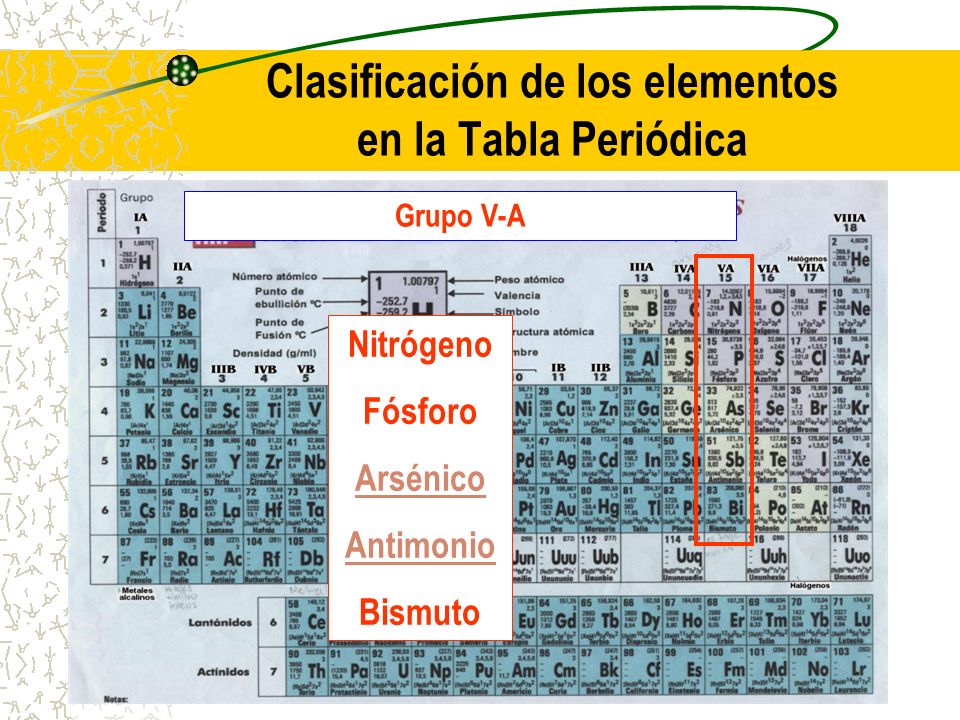
Los Nitrogenoides o Nitrogenoideos son un grupo de elementos conocido como Grupo VA, Grupo 15 o Grupo del Nitrógeno en la Tabla Periódica de los Elementos.
Estos elementos componen el 0,33% en masa de la corteza terrestre y muy pocas veces se hallan nativos en la naturaleza y generalmente se encuentran en forma de compuestos ya sea óxidos, sulfuros, fosfatos, entre otros. Mediante la reducción de los óxidos con carbono o por calcinación y reducción de los sulfuros, se pueden obtener los mismos.
El único elemento metálico del grupo, el bismuto, está clasificado en la tabla periódica como “otros metales” junto a los metales de los grupos 13 y 14 . Poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np3 (2 electrones s y 3 electrones p), exhibiendo los siguientes estados de oxidación: +3, +5 y -3. A medida que crece el número atómico, prevalecerá el estado de oxidación +3.
Elementos
- Nitrógeno (N)
- Fósforo (P)
- Arsénico (As)
- Antimonio (Sb)
- Bismuto (Bi)
- Unumpentio ( Uup)
Propiedades de los Nitrogenoides
- Poseen la siguiente estructura electrónica en la última capa:
N: 2 s² 2 p³
P: 3 s² 3 p³
As: 4 s² 4 p³
Sb: 5 s² 5 p³
Bi: 6 s² 6 p³
- Son muy reactivos a alta temperatura
-Todos poseen al menos el estado de oxidación -3 debido a la facilidad que tienen de ganar o compartir 3 electrones para alcanzar la configuración del gas noble correspondiente
- También poseen el estado de oxidación + 5 de manera que tienen facilidad para perder 5 electrones y quedarse con la configuración de gas noble del periodo anterior
- En este grupo se acentúa la tendencia de las propiedades no metálicas.
- Tienen tendencia a la polimorfia, es decir, existen variedades alotrópicas con
propiedades físico-químicas muy diferentes:
Fósforo blanco, rojo, negro violeta
Arsénico gris, amarillo...
Antimonio gris, amarillo...
Propiedades físicas
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta a medida que se desciende en el mismo. El nitrógeno es un gas diatómico inerte que forma el 78,1 % en volumen del aire atmosférico. Además es un no metal incoloro. Por su parte, el fósforo es un no metal sólido de color blanco, pero puro es incoloro. En sus formas alotrópicas presentan diferentes coloraciones y propiedades. Los más comunes son el fósforo blanco el más tóxico e inflamable, el fósforo rojo es mucho más estable y menos volátil y por último el fósforo negro, el cual presenta una estructura similar al grafito y conduce la electricidad. Además es más denso que las otras dos formas y no se inflama.
Elementos del grupo 15
Los metaloides o semimetales de este grupo son el arsénico y antimonio. Estos elementos se asemejan a los metales en sus propiedades físicas, pero se comportan químicamente como un no metal. El arsénico es metaloide sólido y tóxico de color gris metálico que presenta tres formas alotrópicas:
- El arsénico gris metálico: es la forma más estable de las tres y es un buenconductor del calor pero bastante malo conductor de electricidad.
- El arsénico amarillo: Es enormemente volátil y más reactivo que el arsénico gris metálico y manifiesta fosforescencia a temperatura ambiente.
- El arsénico negro: Presenta propiedades intermedias entre las formas
anteriores.
De igual manera, el antimonio es un semimetal que en su forma elemental es un sólido cristalino de color blanco plateado, fundible, frágil, con una escasa conductividad de calor y electricidad que se evapora a bajas temperaturas. Este metaloide presenta cuatro formas alotrópicas:
- Antimonio puro gris plateado
- Antimonio blanco azulado: es su forma más estable y metálica
- Antimonio negro: Inestable y no metálico
- Antimonio amarillo: Inestable y no metálico
El elemento metálico de este grupo es el bismuto, el cual es cristalino, blanco grisáceo, lustroso, duro y quebradizo. Es uno de los pocos metales que se expanden al solidificarse. Su conductividad térmica es menor que la de cualquier otro metal, con excepción del mercurio.
De manera resumida, las propiedades metálicas de este grupo van incrementando a medida que se desciende en la tabla periódica, desde el nitrógeno al bismuto. Por lo que ocurre una disminución de los puntos de fusión a partir del arsénico, ya que disminuye el carácter covalente de los enlaces y aumenta el carácter metálico.
Propiedades químicas
Los elementos del grupo 15 poseen algunas propiedades químicas similares, entre estas tenemos:
- Son muy reactivos a altas temperaturas
- No reaccionan con el agua
- No reaccionan con ácidos no oxidantes
- Reaccionan con ácidos oxidantes a excepción del nitrógeno.
- Forman óxidos con número de oxidación +3 y +5, a excepción del nitrógeno que forma óxidos entre los rango +1 y +5.
- Los hidróxidos que forman disminuyen su acidez a medida que se desciende en el grupo, siendo básico el hidróxido de bismuto (III).
- El bismuto reacciona con el oxígeno y con halógenos, produciendo bismita y bismutina entre otros compuestos.
Aplicaciones
- Nitrógeno (N): El nitrógeno es un gas diatónico que presenta una gran cantidad de aplicaciones
industriales.
El gas nitrógeno se emplea usualmente en la parte superior de los explosivos líquidos para evitar que estallen. En menor escala se utiliza para inflar los neumáticos o llantas de los aviones y los automóviles. Aunque, en los automóviles comerciales es usual emplear aire normal.
También se pueden inflar neumáticos con nitrógeno gaseoso.
El gas nitrógeno se utiliza como un gas aislador, cuando se seca y se presuriza, para equipos de alta tensión.
El nitrógeno también se emplea en la elaboración de bombillas como una opción más económica en comparación con el gas noble argón.
Entre otros usos del gas nitrógeno tenemos:
-En la fabricación de piezas eléctricas tales como transistores, diodos y circuitos integrados.
En la elaboración de acero inoxidable. Para disminuir el peligro de incendio en los sistemas militares de combustible de aeronaves. Se emplea como una alternativa al dióxido de carbono en la presurización de cerveza. En la industria alimentaria se emplea para conservar los alimentos envasados al interrumpir la oxidación de los mismos. Por ejemplo, para inflar los envoltorios que contienen alimentos, como los de frituras, y así mantenerlos frescos más tiempo. En medicina el nitrógeno es un elemento importante de casi todas las drogas farmacológicas. El óxido nitroso comúnmente llamado “gas de la risa” se utiliza como un anestésico. Por su parte, el nitrógeno en su forma líquida, es usado en gastronomía para cocinar al frío los alimentos.
Con la técnica del nitrógeno líquido se puede acelerar la cocción para descartar los procesos bacterianos y para reducir que las pérdidas de propiedades organolépticas generen un deterioro. También se utiliza en la preparación de helados. El nitrógeno líquido se usa en la preparación de cócteles.
En el campo de la medicina y la biología, se utiliza también el nitrógeno líquido en una técnica llamada criopreservación. Esta técnica consiste en la congelación a muy bajas temperaturas (entre -80 ºC y -196 ºC) de células o tejidos para reducir las funciones vitales de una célula o un organismo y poder conservarlo en ambientes de vida suspendida por mucho tiempo.
Criopreservación de embriones
De igual manera es usado el nitrógeno líquido para enfriar los detectores de rayos X y las unidades centrales de procesamiento en las computadoras cuando están calientes.
Fósforo (P)
-Al igual que el nitrógeno, el fósforo presenta un sinfín de aplicaciones. De hecho el fósforo es un componente importante del ADN y ARN y es un nutriente fundamental para las plantas, por lo cual se agrega a los fertilizantes para su elaboración.
-El fósforo en forma de fosfatos esta presente en el ADN
-El fósforo rojo se emplea en la fabricaciónde cerillos, fósforos de seguridad, cohetes y en la elaboración de acero.
-En su forma alotrópica blanca, es usado en bombas incendiarias, bombas de humo y en munición trazadora.
 -Los isótopos radiactivos de fósforo son utilizados en laboratorios como trazadores radiactivos para ayudar a comprender las reacciones e interacciones químicas.
-Los compuestos de fósforo también son ampliamente utilizados, por ejemplo los fosfatos se emplean para fabricar un vidrio especial que se usa en las lámparas de sodio.
-El tributilfosfato se emplea el proceso purex para extraer uranio.
-El fosfato de calcio es usado para elaborar porcelana fina.
-El tripolifosfato de sodio se emplea en algunos países como detergentes para ropa. Sin embargo, se ha prohibido en otros países debido a que provoca la muerte de los peces cuando pasa hacia las vías fluviales.
-Detergentes con fosfato
-Otros compuestos de fósforo son empleados en la elaboración de pesticidas, fertilizantes, aditivos alimentarios y pasta dentales.
-Los isótopos radiactivos de fósforo son utilizados en laboratorios como trazadores radiactivos para ayudar a comprender las reacciones e interacciones químicas.
-Los compuestos de fósforo también son ampliamente utilizados, por ejemplo los fosfatos se emplean para fabricar un vidrio especial que se usa en las lámparas de sodio.
-El tributilfosfato se emplea el proceso purex para extraer uranio.
-El fosfato de calcio es usado para elaborar porcelana fina.
-El tripolifosfato de sodio se emplea en algunos países como detergentes para ropa. Sin embargo, se ha prohibido en otros países debido a que provoca la muerte de los peces cuando pasa hacia las vías fluviales.
-Detergentes con fosfato
-Otros compuestos de fósforo son empleados en la elaboración de pesticidas, fertilizantes, aditivos alimentarios y pasta dentales.
Arsénico (As)
El arsénico en su forma metálica es usado en aleaciones con cobre y plomo en la fabricación de baterías para automóviles, ya que le proporciona dureza y fortalecimiento a la misma. También se emplea en la industria electrónica en dispositivos semiconductores para elaborar láseres.


Otro tipo de aleación es mezclado en pequeñas cantidades con el alfa latón para que sea más duro y resistente a la lixiviación de zinc. El alfa latón se emplea para elaborar piezas de tuberías u otros artículos que están en contacto constante con el agua.
Este metaloide es ampliamente usado en la fabricación de pesticidas, herbicidas e
insecticidas, aunque actualmente se ha estado prohibiendo por su alta toxicidad.
Pesticidas, herbicidas e insecticidas Debido a su toxicidad, es usado como conservante de madera y así evitar el contacto con insectos, bacterias y hongos.
El arsénico se usa como conservante de madera En medicina fue usado en el tratamiento de algunas enfermedades como la sífilis, mucho antes del descubrimiento de la penicilina. Actualmente es utilizado como aditivo en pequeñas cantidades en los alimentos de animales para prevenir enfermedades y ayudar a su desarrollo. También se emplea en el tratamiento de un tipo de cáncer llamado leucemia promielocítica aguda. Así mismo es empleado en la preparación de soluciones médicas de Fowler para el tratamiento de la psoriasis. Por su parte, el isótopo arsénico-74 usa como una manera de ubicar tumores en el cuerpo. De hecho se origina imágenes más claras que empleando yodo.
Antimonio (Sb)
El antimonio al igual que el arsénico, es ampliamente utilizado en la electrónica como semiconductor en la fabricación de láseres, dispositivos de efecto Hall y detectores infrarrojos.
Láser También es usado en aleaciones con otros elementos como por ejemplo, con estaño para obtener un metal antifricción; igualmente en el peltre, metal inglés, entre otros. De igual manera, se alea con el plomo para fabricar baterías y acumuladores para así proporcionar resistencia a la corrosión y dureza. Esta misma aleación es utilizada para elaborar piezas de imprenta.

Baterías de automóviles.
Los compuestos de antimonio poseen una gran cantidad de aplicaciones industriales, dentro de los cuales se pueden nombrar:
-El trifluoruro de antimonio se utiliza para la fluoración.
-El pentacloruro de antimonio se emplea en la cloración.
-El tricloruro de antimonio se aprovecha como un catalizador para reacciones de polimerización, craqueo y en la cloración. También es un reactivo utilizado en la prueba de Carr-Price para determinar la vitamina A y otros carotenoides.
-El óxido de antimonio III es usado como retardante de la llama de plásticos, catalizador para fibras plásticas, pigmentos, fritas cerámicas y ciertos minerales.
-El doble tartrato de antimonio y potasio se utiliza en el campo de la medicina
-El sulfuro de antimonio rojo se emplea en equipos de seguridad y en el vulcanizado del caucho.
-El isótopo radiactivo Sb-124 se utiliza como trazador en los oleoductos. La mezcla de óxido y sulfuro de antimonio se usa como tinte amarillo para el vidrio y la cerámica
Bismuto (Bi)
 Este metal es usado en aleaciones debido a que presentan baja temperatura de fusión por lo cual lo hace idóneo para ser empleado abundantemente en la detección de incendios y dispositivos de supresión del sistema de seguridad. Sus aleaciones también son usadas en esmaltes cerámicos, plomadas de pesca, aparatos de procesamiento de alimentos, en plomería, soldaduras, entre otros.
Este metal es usado en aleaciones debido a que presentan baja temperatura de fusión por lo cual lo hace idóneo para ser empleado abundantemente en la detección de incendios y dispositivos de supresión del sistema de seguridad. Sus aleaciones también son usadas en esmaltes cerámicos, plomadas de pesca, aparatos de procesamiento de alimentos, en plomería, soldaduras, entre otros.
Las aleaciones de bismuto han tenido un auge comercial importante ya que se emplea como reemplazo del tóxico plomo.
Los compuestos de bismuto poseen una variedad de usos en cosméticos, por ejemplo el oxicloruro de bismuto, usualmente es empleado como pigmento en sombras de ojos, espray para el cabello y esmalte para uñas. También es usado para tratar la diarrea y la acidez estomacal.
GRUPO IVA DE LA TABLA PERIÓDICA

Propiedades
Los elementos del grupo IVA son: carbono(C), silicio(si), germanio(ge), estaño(Sn),plomo(Pb), erristeneo(Eo). Estos elementos forman más de la cuarta parte de la corteza terrestre y solo podemos encontrar en forma natural al carbono al estaño y al plomo en forma de óxidos y sulfuros, su configuración electrónica termina en ns2,p2.
Los elementos de este grupo presenta diferentes estados de oxidación y estos son: +2 y +4., los compuestos orgánicos presentan variedad en su oxidación Mientras que los óxidos de carbono y silicio son ácidos, los del estaño y plomo son anfótero, el plomo es un elemento tóxico. Estos elementos no suelen reaccionar con el agua, los ácidos reaccionan con el germanio, estaño y plomo, las bases fuertes atacan a los elementos de este grupo, con la excepción del carbono, desprendiendo hidrógeno, reaccionan con el oxígeno formando óxidos.
En este grupo encontramos variedad en cuanto a sus características físicas y químicas a continuación un breve resumen de cada uno de los elementos de este grupo.
Carbono (C)
Es un elemento químico de número atómico 6, es un sólido a temperatura ambiente. Es el pilar básico de la química orgánica; se conocen cerca de 16 millones de compuestos de carbono, aumentando este número en unos 500.000 compuestos por año, y forma parte de todos los seres vivos conocidos. Forma el 0,2 % de la corteza terrestre.
-Características
El carbono es un elemento que posee formas alotrópicas, un caso fascinante lo encontramos en el grafito y en el diamante, el primero corresponde a uno de las sustancias más blandas y el segundo a uno de los elementos más duros y otro caso con el carbón y el diamante, el carbón es tienen un precio comercial bastante bajo en cambio el diamante es conocido por ser una de las piedras mas costosas del mundo. Presenta una gran afinidad para enlazarse químicamente con otros átomos pequeños, incluyendo otros átomos de carbono con los que puede formar largas cadenas, y su pequeño radio atómico le permite formar enlaces múltiples. Así, con el oxígeno forma el dióxido de carbono, vital para el crecimiento de las plantas, con el hidrógeno forma numerosos compuestos denominados genéricamente hidrocarburos.
Estados alotrópicos
Se conocen cinco formas alotrópicas del carbono, una de las formas como encontramos el carbono es el grafito el grafito tienen exactamente la misma cantidad de átomos que el diamante la única variación que este presenta esta en la estructura la estructura del diamante es tetraédrica y la del grafito es mucho más sencilla. Pero por estar dispuestos en diferente forma, su textura, fuerza y color son diferentes.
Silicio (Si)
Es un metaloide de numero atómico 14 de grupo A4. El silicio es el segundo elemento más abundante de la corteza terrestre (27,7% en peso) Se presenta en forma amorfa y cristalizada; el primero es un polvo parduzco, más activo que la variante cristalina, que se presenta en octaedros de color azul grisáceo y brillo metálico.
Características
En forma cristalina es muy duro y poco soluble y presenta un brillo metálico y color grisáceo. Aunque es un elemento relativamente inerte y resiste la acción de la mayoría de los ácidos, reacciona con los halógenos y álcalis diluidos. El silicio transmite más del 95% de las longitudes de onda de la radiación infrarroja.
Se prepara en forma de polvo amarillo pardo o de cristales negros-grisáceos. Se obtiene calentando sílice, o dióxido de silicio (SiO2), El silicio cristalino tiene una dureza de 7, suficiente para rayar el vidrio, de dureza de 5 a 7. El silicio tiene un punto de fusión de 1.411 °C, un punto de ebullición de 2.355 °C y una densidad relativa de 2,33(g/ml). Su masa atómica es 28,086 u
Estados del silicio
El silicio lo podemos encontrar en diversas formas en polvo, policristal ver y olivino
Aplicaciones
Se utiliza en aleaciones, en la preparación de las siliconas, en la industria de la cerámica técnica y, debido a que es un material semiconductor muy abundante, tiene un interés especial en la industria electrónica y microelectrónica como material básico para la creación de obleas o chips que se pueden implantar en transistores, pilas solares y una gran variedad de circuitos electrónicos. El silicio es un elemento vital en numerosas industrias.
Germanio (Ge)
Elemento químico, metálico, gris plata, quebradizo, símbolo Ge, número atómico 32, peso atómico 72.59, punto de fusión 937.4ºC (1719ºF) y punto de ebullición 2830ºC (5130ºF), con propiedades entre el silicio y estaño. El germanio se encuentra muy distribuido en la corteza terrestre con una abundancia de 6.7 partes por millon (ppm). El germanio tiene una apariencia metálica, pero exhibe las propiedades físicas y químicas de un metal sólo en condiciones especiales, dado que está localizado en la tabla periódica en donde ocurre la transición de metales a no metales.
Características
Es un metaloide sólido duro, cristalino, de color blanco grisáceo lustroso, quebradizo, que conserva el brillo a temperaturas ordinarias. Presenta la misma estructura cristalina que el diamante y resiste a los ácidos y álcalis.
Forma gran número de compuestos organometálicos y es un importante materialsemiconductor utilizado en transistores y fotodetectores. A diferencia de la mayoría de semiconductores, el germanio tiene una pequeña banda prohibida (band gap) por lo que responde de forma eficaz a la radiación infrarroja y puede usarse en amplificadores de baja intensidad.
Aplicaciones
Las aplicaciones del germanio se ven limitadas por su elevado costo y en muchos casos se investiga su sustitución por materiales más económicos Fibra óptica. Electrónica: radares y amplificadores de guitarras eléctricas usados por músicos nostálgicos del sonido de la primera época del rock and roll; aleaciones SiGe en circuitos integrados de alta velocidad. También se utilizan compuestos sándwich
Si/Ge para aumentar la movilidad de los electrones en el silicio (streched silicon).Óptica de infrarrojos: Espectroscopios, sistemas de visión nocturna y otros equipos. Lentes, con alto índice de refracción, de ángulo ancho y para microscopios. En joyería se usa la aleación Au con 12% de germanio.
Estaño (Sn)
El estaño se conoce desde antiguo: en Mesopotamia se hacían armas de bronce, Plinio menciona una aleación de estaño y plomo, los romanos recubrían con estaño el interior de recipientes de cobre. Representa el 0,00023% en peso de la corteza. Raramente se encuentra nativo, siendo su principal mineral la casiterita (SnO2). También tiene importancia la estannita o pirita de estaño. La casiterita se muele y enriquece en SnO2 por flotación, éste se tuesta y se calienta con coque en un horno, con lo que se obtiene el metal. Para purificarlo (sobre todo de hierro) se eliminan las impurezas subiendo un poco por encima de la temperatura de fusión del estaño, con lo que éste sale en forma líquida.
Características
Es un metal, maleable, que no se oxida y es resistente a la corrosión. Se encuentra en muchas aleaciones y se usa para recubrir otros metales protegiéndolos de la corrosión. Una de sus características más llamativas es que bajo determinadas condiciones forma la peste del estaño.
Formas alotrópicas
El estaño puro tiene dos variantes alotrópicas: El estaño gris, polvo no metálico, conductor, de estructura cúbica y estable a temperaturas inferiores a 13,2 °C, que es muy frágil y tiene un peso específico más bajo que el blanco
Aplicaciones:
Se usa como revestimiento protector del cobre, del hierro y de diversos metales usados en la fabricación de latas de conserva. También se usa para disminuir la fragilidad del vidrio. Los compuestos de estaño se usan para fungicidas, tintes, dentífricos (SnF2) y pigmentos. Se usa para hacer bronce, aleación de estaño y cobre. Se usa para la soldadura blanda, aleado con plomo. Se usa en aleación con plomo para fabricar la lámina de los tubos de los órganos musicales. En etiquetas. Recubrimiento de acero. Se usa como material de aporte en soldadura blanda con cautín, bien puro o acerado. La directiva RoHS prohíbe el uso de plomo en la soldadura de determinados aparatos eléctricos y electrónicos. El estaño también se utiliza en la industria de la cerámica para la fabricación de los esmaltes cerámicos. Su función es la siguiente: en baja y en alta es un o pacificante. En alta la proporción del porcentaje es más alto que en baja temperatura.
Plomo (Pb)
Es un elemento de la tabla periódica, cuyo símbolo es Pb y su número atómico es 82 Dmitri Mendeléyev químico no lo reconocía como un elemento metálico común por su gran elasticidad molecular. Cabe destacar que la elasticidad de este elemento depende de las temperaturas del ambiente, las cuales distienden sus átomos, o los extienden. El plomo es un metal de densidad relativa 11,45 a 16 °C tiene una plateada con tono azulado, que se empaña para adquirir un color gris mate. Es flexible, in-elástico y se funde con facilidad. Su fusión se produce a 326,4 °C y hierve a 1745 °C. Las valencias químicas normales son 2 y 4.
Aplicaciones
El plomo se usa como cubierta para cables, ya sea la de teléfono, de televisión, de Internet o de electricidad, sigue siendo una forma de empleo adecuada. La ductilidad única del plomo lo hace particularmente apropiado para esta aplicación, porque puede estirarse para formar un forro continuo alrededor de los conductores internos. Se utilizan una gran variedad de compuestos de plomo, como los silicatos, los carbonatos y sales de ácidos orgánicos, como estabilizadores contra el calor y la luz para los plásticos de cloruro de polivinilo. Se usan silicatos de plomo para la fabricación de frituras (esmaltes) de vidrio y de cerámica, las que resultan útiles para introducir plomo en los acabados del vidrio y de la cerámica. La asida de plomo, Pb(N3)2, es el detonador estándar para los explosivos plásticos como el C-4. Los arseniatos de plomo se emplean en grandes cantidades como insecticidas para la protección de los cultivos y para ahuyentar insectos molestos como lo son cucarachas, mosquitos y otros animales que posean un exoesqueleto. El litargirio (óxido de plomo) se emplea mucho para mejorar las propiedades magnéticas de los imanes de cerámica de ferrita de bario.

webgrafias:
http://elementos.org.es/astato
https://es.wikipedia.org/wiki/Ox%C3%ADgeno#Caracter.C3.ADsticas
http://www.fullquimica.com/2011/11/tabla-periodica-grupo-viia-halogenos.html
http://es.slideshare.net/Akasuna89/familia-vi-a
http://elementos.org.es/nitrogeno



- selenio:
El selenio presenta tres formas alotrópicas:
- Se rojo: constituido por moléculas Se8.
- Se negro: anillos Sen con n muy grande y variable (forma amorfa).
- Se gris: de estructura similar a la del azufre plástico. Este alótropo presenta
aspecto metálico (es un semimetal) y es fotoconductor.

- Teluro (Te)
Presenta una única variedad alotrópica, el Te gris, similar al Se gris. Tiene un carácter más metálico que el anterior.

- polonio:
Presenta dos alótropos: cúbico simple y romboédrico, en los que cada átomo está directamente rodeado por seis vecinos a distancias iguales (d0=355pm). Ambos alótropos tienen carácter metálico.

Carácter metálico en el grupo
Los elementos de este grupo muestran una transición paulatina desde las propiedades típicamente covalentes en la parte alta del grupo hasta las típicamente metálicas del elemento más pesado; y constituyen un excelente ejemplo de como los modelos de enlace covalente y metálico son, únicamente, casos extremos imaginarios de una situación real más compleja de interpretar. Este aumento se pone de manifiesto no solo en la variación progresiva de sus propiedades físicas y
químicas sino también en cambios en sus estructuras.
Reactividad
- Oxígeno
- Reactividad con los principales elementos de la tabla periódica.
- Relación entre reactividad y estructura del elemento.
Ozono
Mayor reactividad del ozono, tanto desde el punto de vista termodinámico como cinético. La gran diferencia de reactividad entre los dos alótropos del oxígeno pone de manifiesto que las propiedades químicas dependen del estado elemental.
Resto del grupo
La reactividad del resto de los calcógenos va siendo cada vez menor a medida que descendemos en el grupo.
Reactividad con elementos y compuestos.
Reactividad en disolución acuosa: se comportan como oxidantes bastante buenos debido a la general insolubilidad de los calcogenuros, que retiran de inmediato iones. El2- del medio, favoreciendo la reacción. También se pueden comportar como reductores, pasando a estados de oxidación formal positivos.
Aplicaciones
Los elementos del grupo vi a, conocidos como la familia del grupo del oxígeno, comprenden al oxigeno (o), azufre (s), selenio (se), telurio (te) y polonio (po). aunque todos ellos tienen seis electrones de valencia, sus propiedades varían de no metálicas a metálicas en cierto grado, conforme aumenta el numero atómico.
- Oxígeno: Como oxígeno molecular (O2 ) se utiliza en la industria del acero, en el tratamiento de aguas negras, en el blanqueado de pulpa y papel, en sopletes oxiacetilénicos, en medicina y en numerosas reacciones como agente oxidante.
El oxigeno gaseoso, O2 es fundamental para la vida; es necesario para quemar los combustibles fósiles y obtener así energía, y se requiere durante el metabolismo urbano para quemar carbohidratos. en ambos procesos, los productos secundarios son dióxido de carbono y agua. El oxigeno constituye
el 21 % en volumen del aire y el 49.5 % en peso de la corteza terrestre. La otro forma alotrópica del oxigeno es el ozono, cuya fórmula es o3 es mas reactivo que el oxigeno ordinario y se puede formar a partir de oxigeno en un arco eléctrico, como el descargador a distancia de un motor eléctrico, también
se puede producir ozono por la acción de la luz ultravioleta sobre el oxigeno; esto explica el aroma " fresco del aire durante las tormentas eléctricas".
- Azufre: El azufre es el segundo elemento no metal del grupo. a temperatura ambiente es un sólido amarillo pálido que se encuentra libre en la naturaleza. lo conocían los antiguos y se le menciona en el libro del génesis como piedra de azufre. las moléculas de azufre contienen ocho átomos de azufre
conectados a un anillo; su fórmula es s8 . el azufre tiene una importancia especial en la manufactura de neumáticos de hule y acido sulfúrico, H2SO4 . Otros compuestos de azufre son importantes para blanquear frutos y granos Se usa en muchos procesos industriales como la producción de ácido sulfúrico (sustancia química más importante a nivel industrial), en la fabricación de pólvora y el vulcanizado del caucho. Algunos compuestos como los sulfitos tienen propiedades blanqueadoras, otros tienen uso medicinal (sulfas, sulfato de magnesio). También se utiliza en la elaboración de fertilizantes y como fungicida.
-Selenio: El selenio es un no metal que presenta interesantes propiedades y usos. la conductividad de este elemento aumenta con la intensidad de la luz. a causa de esta fotoconductividad, el selenio se a utilizado en los medidores de luz para camaras fotograficas y en fotocopiadoras, pero la preocupación que origina su toxicidad ha hecho que disminuya su uso. el selenio tambien puede convertir la corriente electrica alterna en corriente directa; se ha utilizado en rectificadores, como los convertidores que se usan en los radios y grabadores portátiles, y en herramientas electricas recargables. el color rojo que el selenio imparte al vidrio lo hace util en la fabricación de lentes para señales luminosas.
Se utiliza básicamente en electricidad y electrónica, como en células solares y rectificadores. Se añade a los aceros inoxidables y es catalizador de reacciones de deshidrogenación. Algunos compuestos se emplean en la fabricación del vidrio y esmaltes. Los sulfuros se usan en medicina veterinaria y champús. El dióxido de selenio es un catalizador muy utilizado en reacciones de oxidación, hidrogenación y deshidrogenación de compuesos orgánicos.
- Telurio: El telurio, tiene aspecto metalico, pero es un metaloide en el que predominan las propiedades no metalicas. se emplea en semiconductores y para endurecer las placas de los acumuladores de plomo y el hierro colado. se presenta en la naturaleza en diversos compuestos, pero no es abundante. el polonio es un elemento radiactivo poco comun que emite radiación alfa y
gama; su manejo es muy peligroso. los usos de este elemento se relacionan con su radiactividad, y fue descubierto por marie curie, quien le dio este nombre en honor a su natal polonia.
Se emplea para aumentar la resistencia a la tensión en aleaciones de cobre y plomo y en la fabricación de dispositivos termoeléctricos. También se utiliza como agente vulcanizador y en la industria del vidrio. El telurio coloidal es insecticida y fungicida.
- Polonio: los isótopos constituyen una fuente de radiación alfa. Se usan en la investigación nuclear. Otro uso es en dispositivos ionizadores del aire para eliminar la acumulación de cargas electrostáticas.
GRUPO VA DE LA TABLA PERIÓDICA

Los Nitrogenoides o Nitrogenoideos son un grupo de elementos conocido como Grupo VA, Grupo 15 o Grupo del Nitrógeno en la Tabla Periódica de los Elementos.
Estos elementos componen el 0,33% en masa de la corteza terrestre y muy pocas veces se hallan nativos en la naturaleza y generalmente se encuentran en forma de compuestos ya sea óxidos, sulfuros, fosfatos, entre otros. Mediante la reducción de los óxidos con carbono o por calcinación y reducción de los sulfuros, se pueden obtener los mismos.
El único elemento metálico del grupo, el bismuto, está clasificado en la tabla periódica como “otros metales” junto a los metales de los grupos 13 y 14 . Poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np3 (2 electrones s y 3 electrones p), exhibiendo los siguientes estados de oxidación: +3, +5 y -3. A medida que crece el número atómico, prevalecerá el estado de oxidación +3.
Elementos
- Nitrógeno (N)
- Fósforo (P)
- Arsénico (As)
- Antimonio (Sb)
- Bismuto (Bi)
- Unumpentio ( Uup)
Propiedades de los Nitrogenoides
- Poseen la siguiente estructura electrónica en la última capa:
N: 2 s² 2 p³
P: 3 s² 3 p³
As: 4 s² 4 p³
Sb: 5 s² 5 p³
Bi: 6 s² 6 p³
- Son muy reactivos a alta temperatura
-Todos poseen al menos el estado de oxidación -3 debido a la facilidad que tienen de ganar o compartir 3 electrones para alcanzar la configuración del gas noble correspondiente
- También poseen el estado de oxidación + 5 de manera que tienen facilidad para perder 5 electrones y quedarse con la configuración de gas noble del periodo anterior
- En este grupo se acentúa la tendencia de las propiedades no metálicas.
- Tienen tendencia a la polimorfia, es decir, existen variedades alotrópicas con
propiedades físico-químicas muy diferentes:
Fósforo blanco, rojo, negro violeta
Arsénico gris, amarillo...
Antimonio gris, amarillo...
Propiedades físicas
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta a medida que se desciende en el mismo. El nitrógeno es un gas diatómico inerte que forma el 78,1 % en volumen del aire atmosférico. Además es un no metal incoloro. Por su parte, el fósforo es un no metal sólido de color blanco, pero puro es incoloro. En sus formas alotrópicas presentan diferentes coloraciones y propiedades. Los más comunes son el fósforo blanco el más tóxico e inflamable, el fósforo rojo es mucho más estable y menos volátil y por último el fósforo negro, el cual presenta una estructura similar al grafito y conduce la electricidad. Además es más denso que las otras dos formas y no se inflama.
Elementos del grupo 15
Los metaloides o semimetales de este grupo son el arsénico y antimonio. Estos elementos se asemejan a los metales en sus propiedades físicas, pero se comportan químicamente como un no metal. El arsénico es metaloide sólido y tóxico de color gris metálico que presenta tres formas alotrópicas:
- El arsénico gris metálico: es la forma más estable de las tres y es un buenconductor del calor pero bastante malo conductor de electricidad.
- El arsénico amarillo: Es enormemente volátil y más reactivo que el arsénico gris metálico y manifiesta fosforescencia a temperatura ambiente.
- El arsénico negro: Presenta propiedades intermedias entre las formas
anteriores.
De igual manera, el antimonio es un semimetal que en su forma elemental es un sólido cristalino de color blanco plateado, fundible, frágil, con una escasa conductividad de calor y electricidad que se evapora a bajas temperaturas. Este metaloide presenta cuatro formas alotrópicas:
- Antimonio puro gris plateado
- Antimonio blanco azulado: es su forma más estable y metálica
- Antimonio negro: Inestable y no metálico
- Antimonio amarillo: Inestable y no metálico
El elemento metálico de este grupo es el bismuto, el cual es cristalino, blanco grisáceo, lustroso, duro y quebradizo. Es uno de los pocos metales que se expanden al solidificarse. Su conductividad térmica es menor que la de cualquier otro metal, con excepción del mercurio.
De manera resumida, las propiedades metálicas de este grupo van incrementando a medida que se desciende en la tabla periódica, desde el nitrógeno al bismuto. Por lo que ocurre una disminución de los puntos de fusión a partir del arsénico, ya que disminuye el carácter covalente de los enlaces y aumenta el carácter metálico.
Propiedades químicas
Los elementos del grupo 15 poseen algunas propiedades químicas similares, entre estas tenemos:
- Son muy reactivos a altas temperaturas
- No reaccionan con el agua
- No reaccionan con ácidos no oxidantes
- Reaccionan con ácidos oxidantes a excepción del nitrógeno.
- Forman óxidos con número de oxidación +3 y +5, a excepción del nitrógeno que forma óxidos entre los rango +1 y +5.
- Los hidróxidos que forman disminuyen su acidez a medida que se desciende en el grupo, siendo básico el hidróxido de bismuto (III).
- El bismuto reacciona con el oxígeno y con halógenos, produciendo bismita y bismutina entre otros compuestos.
Aplicaciones
- Nitrógeno (N): El nitrógeno es un gas diatónico que presenta una gran cantidad de aplicaciones
industriales.
El gas nitrógeno se emplea usualmente en la parte superior de los explosivos líquidos para evitar que estallen. En menor escala se utiliza para inflar los neumáticos o llantas de los aviones y los automóviles. Aunque, en los automóviles comerciales es usual emplear aire normal.
También se pueden inflar neumáticos con nitrógeno gaseoso.
El gas nitrógeno se utiliza como un gas aislador, cuando se seca y se presuriza, para equipos de alta tensión.
El nitrógeno también se emplea en la elaboración de bombillas como una opción más económica en comparación con el gas noble argón.
Entre otros usos del gas nitrógeno tenemos:
-En la fabricación de piezas eléctricas tales como transistores, diodos y circuitos integrados.
En la elaboración de acero inoxidable. Para disminuir el peligro de incendio en los sistemas militares de combustible de aeronaves. Se emplea como una alternativa al dióxido de carbono en la presurización de cerveza. En la industria alimentaria se emplea para conservar los alimentos envasados al interrumpir la oxidación de los mismos. Por ejemplo, para inflar los envoltorios que contienen alimentos, como los de frituras, y así mantenerlos frescos más tiempo. En medicina el nitrógeno es un elemento importante de casi todas las drogas farmacológicas. El óxido nitroso comúnmente llamado “gas de la risa” se utiliza como un anestésico. Por su parte, el nitrógeno en su forma líquida, es usado en gastronomía para cocinar al frío los alimentos.
Con la técnica del nitrógeno líquido se puede acelerar la cocción para descartar los procesos bacterianos y para reducir que las pérdidas de propiedades organolépticas generen un deterioro. También se utiliza en la preparación de helados. El nitrógeno líquido se usa en la preparación de cócteles.
En el campo de la medicina y la biología, se utiliza también el nitrógeno líquido en una técnica llamada criopreservación. Esta técnica consiste en la congelación a muy bajas temperaturas (entre -80 ºC y -196 ºC) de células o tejidos para reducir las funciones vitales de una célula o un organismo y poder conservarlo en ambientes de vida suspendida por mucho tiempo.
Criopreservación de embriones
De igual manera es usado el nitrógeno líquido para enfriar los detectores de rayos X y las unidades centrales de procesamiento en las computadoras cuando están calientes.
Fósforo (P)
-Al igual que el nitrógeno, el fósforo presenta un sinfín de aplicaciones. De hecho el fósforo es un componente importante del ADN y ARN y es un nutriente fundamental para las plantas, por lo cual se agrega a los fertilizantes para su elaboración.
-El fósforo en forma de fosfatos esta presente en el ADN
-El fósforo rojo se emplea en la fabricaciónde cerillos, fósforos de seguridad, cohetes y en la elaboración de acero.
-En su forma alotrópica blanca, es usado en bombas incendiarias, bombas de humo y en munición trazadora.
 -Los isótopos radiactivos de fósforo son utilizados en laboratorios como trazadores radiactivos para ayudar a comprender las reacciones e interacciones químicas.
-Los compuestos de fósforo también son ampliamente utilizados, por ejemplo los fosfatos se emplean para fabricar un vidrio especial que se usa en las lámparas de sodio.
-El tributilfosfato se emplea el proceso purex para extraer uranio.
-El fosfato de calcio es usado para elaborar porcelana fina.
-El tripolifosfato de sodio se emplea en algunos países como detergentes para ropa. Sin embargo, se ha prohibido en otros países debido a que provoca la muerte de los peces cuando pasa hacia las vías fluviales.
-Detergentes con fosfato
-Otros compuestos de fósforo son empleados en la elaboración de pesticidas, fertilizantes, aditivos alimentarios y pasta dentales.
-Los isótopos radiactivos de fósforo son utilizados en laboratorios como trazadores radiactivos para ayudar a comprender las reacciones e interacciones químicas.
-Los compuestos de fósforo también son ampliamente utilizados, por ejemplo los fosfatos se emplean para fabricar un vidrio especial que se usa en las lámparas de sodio.
-El tributilfosfato se emplea el proceso purex para extraer uranio.
-El fosfato de calcio es usado para elaborar porcelana fina.
-El tripolifosfato de sodio se emplea en algunos países como detergentes para ropa. Sin embargo, se ha prohibido en otros países debido a que provoca la muerte de los peces cuando pasa hacia las vías fluviales.
-Detergentes con fosfato
-Otros compuestos de fósforo son empleados en la elaboración de pesticidas, fertilizantes, aditivos alimentarios y pasta dentales.
Arsénico (As)
El arsénico en su forma metálica es usado en aleaciones con cobre y plomo en la fabricación de baterías para automóviles, ya que le proporciona dureza y fortalecimiento a la misma. También se emplea en la industria electrónica en dispositivos semiconductores para elaborar láseres.


Otro tipo de aleación es mezclado en pequeñas cantidades con el alfa latón para que sea más duro y resistente a la lixiviación de zinc. El alfa latón se emplea para elaborar piezas de tuberías u otros artículos que están en contacto constante con el agua.
Este metaloide es ampliamente usado en la fabricación de pesticidas, herbicidas e
insecticidas, aunque actualmente se ha estado prohibiendo por su alta toxicidad.
Pesticidas, herbicidas e insecticidas Debido a su toxicidad, es usado como conservante de madera y así evitar el contacto con insectos, bacterias y hongos.
El arsénico se usa como conservante de madera En medicina fue usado en el tratamiento de algunas enfermedades como la sífilis, mucho antes del descubrimiento de la penicilina. Actualmente es utilizado como aditivo en pequeñas cantidades en los alimentos de animales para prevenir enfermedades y ayudar a su desarrollo. También se emplea en el tratamiento de un tipo de cáncer llamado leucemia promielocítica aguda. Así mismo es empleado en la preparación de soluciones médicas de Fowler para el tratamiento de la psoriasis. Por su parte, el isótopo arsénico-74 usa como una manera de ubicar tumores en el cuerpo. De hecho se origina imágenes más claras que empleando yodo.
Antimonio (Sb)
El antimonio al igual que el arsénico, es ampliamente utilizado en la electrónica como semiconductor en la fabricación de láseres, dispositivos de efecto Hall y detectores infrarrojos.
Láser También es usado en aleaciones con otros elementos como por ejemplo, con estaño para obtener un metal antifricción; igualmente en el peltre, metal inglés, entre otros. De igual manera, se alea con el plomo para fabricar baterías y acumuladores para así proporcionar resistencia a la corrosión y dureza. Esta misma aleación es utilizada para elaborar piezas de imprenta.

Baterías de automóviles.
Los compuestos de antimonio poseen una gran cantidad de aplicaciones industriales, dentro de los cuales se pueden nombrar:
-El trifluoruro de antimonio se utiliza para la fluoración.
-El pentacloruro de antimonio se emplea en la cloración.
-El tricloruro de antimonio se aprovecha como un catalizador para reacciones de polimerización, craqueo y en la cloración. También es un reactivo utilizado en la prueba de Carr-Price para determinar la vitamina A y otros carotenoides.
-El óxido de antimonio III es usado como retardante de la llama de plásticos, catalizador para fibras plásticas, pigmentos, fritas cerámicas y ciertos minerales.
-El doble tartrato de antimonio y potasio se utiliza en el campo de la medicina
-El sulfuro de antimonio rojo se emplea en equipos de seguridad y en el vulcanizado del caucho.
-El isótopo radiactivo Sb-124 se utiliza como trazador en los oleoductos. La mezcla de óxido y sulfuro de antimonio se usa como tinte amarillo para el vidrio y la cerámica
Bismuto (Bi)
 Este metal es usado en aleaciones debido a que presentan baja temperatura de fusión por lo cual lo hace idóneo para ser empleado abundantemente en la detección de incendios y dispositivos de supresión del sistema de seguridad. Sus aleaciones también son usadas en esmaltes cerámicos, plomadas de pesca, aparatos de procesamiento de alimentos, en plomería, soldaduras, entre otros.
Este metal es usado en aleaciones debido a que presentan baja temperatura de fusión por lo cual lo hace idóneo para ser empleado abundantemente en la detección de incendios y dispositivos de supresión del sistema de seguridad. Sus aleaciones también son usadas en esmaltes cerámicos, plomadas de pesca, aparatos de procesamiento de alimentos, en plomería, soldaduras, entre otros.
Las aleaciones de bismuto han tenido un auge comercial importante ya que se emplea como reemplazo del tóxico plomo.
Los compuestos de bismuto poseen una variedad de usos en cosméticos, por ejemplo el oxicloruro de bismuto, usualmente es empleado como pigmento en sombras de ojos, espray para el cabello y esmalte para uñas. También es usado para tratar la diarrea y la acidez estomacal.
GRUPO IVA DE LA TABLA PERIÓDICA

Propiedades
Los elementos del grupo IVA son: carbono(C), silicio(si), germanio(ge), estaño(Sn),plomo(Pb), erristeneo(Eo). Estos elementos forman más de la cuarta parte de la corteza terrestre y solo podemos encontrar en forma natural al carbono al estaño y al plomo en forma de óxidos y sulfuros, su configuración electrónica termina en ns2,p2.
Los elementos de este grupo presenta diferentes estados de oxidación y estos son: +2 y +4., los compuestos orgánicos presentan variedad en su oxidación Mientras que los óxidos de carbono y silicio son ácidos, los del estaño y plomo son anfótero, el plomo es un elemento tóxico. Estos elementos no suelen reaccionar con el agua, los ácidos reaccionan con el germanio, estaño y plomo, las bases fuertes atacan a los elementos de este grupo, con la excepción del carbono, desprendiendo hidrógeno, reaccionan con el oxígeno formando óxidos.
En este grupo encontramos variedad en cuanto a sus características físicas y químicas a continuación un breve resumen de cada uno de los elementos de este grupo.
Carbono (C)
Es un elemento químico de número atómico 6, es un sólido a temperatura ambiente. Es el pilar básico de la química orgánica; se conocen cerca de 16 millones de compuestos de carbono, aumentando este número en unos 500.000 compuestos por año, y forma parte de todos los seres vivos conocidos. Forma el 0,2 % de la corteza terrestre.
-Características
El carbono es un elemento que posee formas alotrópicas, un caso fascinante lo encontramos en el grafito y en el diamante, el primero corresponde a uno de las sustancias más blandas y el segundo a uno de los elementos más duros y otro caso con el carbón y el diamante, el carbón es tienen un precio comercial bastante bajo en cambio el diamante es conocido por ser una de las piedras mas costosas del mundo. Presenta una gran afinidad para enlazarse químicamente con otros átomos pequeños, incluyendo otros átomos de carbono con los que puede formar largas cadenas, y su pequeño radio atómico le permite formar enlaces múltiples. Así, con el oxígeno forma el dióxido de carbono, vital para el crecimiento de las plantas, con el hidrógeno forma numerosos compuestos denominados genéricamente hidrocarburos.
Estados alotrópicos
Se conocen cinco formas alotrópicas del carbono, una de las formas como encontramos el carbono es el grafito el grafito tienen exactamente la misma cantidad de átomos que el diamante la única variación que este presenta esta en la estructura la estructura del diamante es tetraédrica y la del grafito es mucho más sencilla. Pero por estar dispuestos en diferente forma, su textura, fuerza y color son diferentes.
Silicio (Si)
Es un metaloide de numero atómico 14 de grupo A4. El silicio es el segundo elemento más abundante de la corteza terrestre (27,7% en peso) Se presenta en forma amorfa y cristalizada; el primero es un polvo parduzco, más activo que la variante cristalina, que se presenta en octaedros de color azul grisáceo y brillo metálico.
Características
En forma cristalina es muy duro y poco soluble y presenta un brillo metálico y color grisáceo. Aunque es un elemento relativamente inerte y resiste la acción de la mayoría de los ácidos, reacciona con los halógenos y álcalis diluidos. El silicio transmite más del 95% de las longitudes de onda de la radiación infrarroja.
Se prepara en forma de polvo amarillo pardo o de cristales negros-grisáceos. Se obtiene calentando sílice, o dióxido de silicio (SiO2), El silicio cristalino tiene una dureza de 7, suficiente para rayar el vidrio, de dureza de 5 a 7. El silicio tiene un punto de fusión de 1.411 °C, un punto de ebullición de 2.355 °C y una densidad relativa de 2,33(g/ml). Su masa atómica es 28,086 u
Estados del silicio
El silicio lo podemos encontrar en diversas formas en polvo, policristal ver y olivino
Aplicaciones
Se utiliza en aleaciones, en la preparación de las siliconas, en la industria de la cerámica técnica y, debido a que es un material semiconductor muy abundante, tiene un interés especial en la industria electrónica y microelectrónica como material básico para la creación de obleas o chips que se pueden implantar en transistores, pilas solares y una gran variedad de circuitos electrónicos. El silicio es un elemento vital en numerosas industrias.
Germanio (Ge)
Elemento químico, metálico, gris plata, quebradizo, símbolo Ge, número atómico 32, peso atómico 72.59, punto de fusión 937.4ºC (1719ºF) y punto de ebullición 2830ºC (5130ºF), con propiedades entre el silicio y estaño. El germanio se encuentra muy distribuido en la corteza terrestre con una abundancia de 6.7 partes por millon (ppm). El germanio tiene una apariencia metálica, pero exhibe las propiedades físicas y químicas de un metal sólo en condiciones especiales, dado que está localizado en la tabla periódica en donde ocurre la transición de metales a no metales.
Características
Es un metaloide sólido duro, cristalino, de color blanco grisáceo lustroso, quebradizo, que conserva el brillo a temperaturas ordinarias. Presenta la misma estructura cristalina que el diamante y resiste a los ácidos y álcalis.
Forma gran número de compuestos organometálicos y es un importante materialsemiconductor utilizado en transistores y fotodetectores. A diferencia de la mayoría de semiconductores, el germanio tiene una pequeña banda prohibida (band gap) por lo que responde de forma eficaz a la radiación infrarroja y puede usarse en amplificadores de baja intensidad.
Aplicaciones
Las aplicaciones del germanio se ven limitadas por su elevado costo y en muchos casos se investiga su sustitución por materiales más económicos Fibra óptica. Electrónica: radares y amplificadores de guitarras eléctricas usados por músicos nostálgicos del sonido de la primera época del rock and roll; aleaciones SiGe en circuitos integrados de alta velocidad. También se utilizan compuestos sándwich
Si/Ge para aumentar la movilidad de los electrones en el silicio (streched silicon).Óptica de infrarrojos: Espectroscopios, sistemas de visión nocturna y otros equipos. Lentes, con alto índice de refracción, de ángulo ancho y para microscopios. En joyería se usa la aleación Au con 12% de germanio.
Estaño (Sn)
El estaño se conoce desde antiguo: en Mesopotamia se hacían armas de bronce, Plinio menciona una aleación de estaño y plomo, los romanos recubrían con estaño el interior de recipientes de cobre. Representa el 0,00023% en peso de la corteza. Raramente se encuentra nativo, siendo su principal mineral la casiterita (SnO2). También tiene importancia la estannita o pirita de estaño. La casiterita se muele y enriquece en SnO2 por flotación, éste se tuesta y se calienta con coque en un horno, con lo que se obtiene el metal. Para purificarlo (sobre todo de hierro) se eliminan las impurezas subiendo un poco por encima de la temperatura de fusión del estaño, con lo que éste sale en forma líquida.
Características
Es un metal, maleable, que no se oxida y es resistente a la corrosión. Se encuentra en muchas aleaciones y se usa para recubrir otros metales protegiéndolos de la corrosión. Una de sus características más llamativas es que bajo determinadas condiciones forma la peste del estaño.
Formas alotrópicas
El estaño puro tiene dos variantes alotrópicas: El estaño gris, polvo no metálico, conductor, de estructura cúbica y estable a temperaturas inferiores a 13,2 °C, que es muy frágil y tiene un peso específico más bajo que el blanco
Aplicaciones:
Se usa como revestimiento protector del cobre, del hierro y de diversos metales usados en la fabricación de latas de conserva. También se usa para disminuir la fragilidad del vidrio. Los compuestos de estaño se usan para fungicidas, tintes, dentífricos (SnF2) y pigmentos. Se usa para hacer bronce, aleación de estaño y cobre. Se usa para la soldadura blanda, aleado con plomo. Se usa en aleación con plomo para fabricar la lámina de los tubos de los órganos musicales. En etiquetas. Recubrimiento de acero. Se usa como material de aporte en soldadura blanda con cautín, bien puro o acerado. La directiva RoHS prohíbe el uso de plomo en la soldadura de determinados aparatos eléctricos y electrónicos. El estaño también se utiliza en la industria de la cerámica para la fabricación de los esmaltes cerámicos. Su función es la siguiente: en baja y en alta es un o pacificante. En alta la proporción del porcentaje es más alto que en baja temperatura.
Plomo (Pb)
Es un elemento de la tabla periódica, cuyo símbolo es Pb y su número atómico es 82 Dmitri Mendeléyev químico no lo reconocía como un elemento metálico común por su gran elasticidad molecular. Cabe destacar que la elasticidad de este elemento depende de las temperaturas del ambiente, las cuales distienden sus átomos, o los extienden. El plomo es un metal de densidad relativa 11,45 a 16 °C tiene una plateada con tono azulado, que se empaña para adquirir un color gris mate. Es flexible, in-elástico y se funde con facilidad. Su fusión se produce a 326,4 °C y hierve a 1745 °C. Las valencias químicas normales son 2 y 4.
Aplicaciones
El plomo se usa como cubierta para cables, ya sea la de teléfono, de televisión, de Internet o de electricidad, sigue siendo una forma de empleo adecuada. La ductilidad única del plomo lo hace particularmente apropiado para esta aplicación, porque puede estirarse para formar un forro continuo alrededor de los conductores internos. Se utilizan una gran variedad de compuestos de plomo, como los silicatos, los carbonatos y sales de ácidos orgánicos, como estabilizadores contra el calor y la luz para los plásticos de cloruro de polivinilo. Se usan silicatos de plomo para la fabricación de frituras (esmaltes) de vidrio y de cerámica, las que resultan útiles para introducir plomo en los acabados del vidrio y de la cerámica. La asida de plomo, Pb(N3)2, es el detonador estándar para los explosivos plásticos como el C-4. Los arseniatos de plomo se emplean en grandes cantidades como insecticidas para la protección de los cultivos y para ahuyentar insectos molestos como lo son cucarachas, mosquitos y otros animales que posean un exoesqueleto. El litargirio (óxido de plomo) se emplea mucho para mejorar las propiedades magnéticas de los imanes de cerámica de ferrita de bario.

webgrafias:
http://elementos.org.es/astato
https://es.wikipedia.org/wiki/Ox%C3%ADgeno#Caracter.C3.ADsticas
http://www.fullquimica.com/2011/11/tabla-periodica-grupo-viia-halogenos.html
http://es.slideshare.net/Akasuna89/familia-vi-a
http://elementos.org.es/nitrogeno
El selenio presenta tres formas alotrópicas:
- Se rojo: constituido por moléculas Se8.
- Se negro: anillos Sen con n muy grande y variable (forma amorfa).
- Se gris: de estructura similar a la del azufre plástico. Este alótropo presenta
aspecto metálico (es un semimetal) y es fotoconductor.

- Teluro (Te)
Presenta una única variedad alotrópica, el Te gris, similar al Se gris. Tiene un carácter más metálico que el anterior.

- polonio:
Presenta dos alótropos: cúbico simple y romboédrico, en los que cada átomo está directamente rodeado por seis vecinos a distancias iguales (d0=355pm). Ambos alótropos tienen carácter metálico.

Carácter metálico en el grupo
Los elementos de este grupo muestran una transición paulatina desde las propiedades típicamente covalentes en la parte alta del grupo hasta las típicamente metálicas del elemento más pesado; y constituyen un excelente ejemplo de como los modelos de enlace covalente y metálico son, únicamente, casos extremos imaginarios de una situación real más compleja de interpretar. Este aumento se pone de manifiesto no solo en la variación progresiva de sus propiedades físicas y
químicas sino también en cambios en sus estructuras.
Reactividad
- Oxígeno
- Reactividad con los principales elementos de la tabla periódica.
- Relación entre reactividad y estructura del elemento.
Ozono
Mayor reactividad del ozono, tanto desde el punto de vista termodinámico como cinético. La gran diferencia de reactividad entre los dos alótropos del oxígeno pone de manifiesto que las propiedades químicas dependen del estado elemental.
Resto del grupo
La reactividad del resto de los calcógenos va siendo cada vez menor a medida que descendemos en el grupo.
Reactividad con elementos y compuestos.
Reactividad en disolución acuosa: se comportan como oxidantes bastante buenos debido a la general insolubilidad de los calcogenuros, que retiran de inmediato iones. El2- del medio, favoreciendo la reacción. También se pueden comportar como reductores, pasando a estados de oxidación formal positivos.
Aplicaciones
Los elementos del grupo vi a, conocidos como la familia del grupo del oxígeno, comprenden al oxigeno (o), azufre (s), selenio (se), telurio (te) y polonio (po). aunque todos ellos tienen seis electrones de valencia, sus propiedades varían de no metálicas a metálicas en cierto grado, conforme aumenta el numero atómico.
- Oxígeno: Como oxígeno molecular (O2 ) se utiliza en la industria del acero, en el tratamiento de aguas negras, en el blanqueado de pulpa y papel, en sopletes oxiacetilénicos, en medicina y en numerosas reacciones como agente oxidante.
El oxigeno gaseoso, O2 es fundamental para la vida; es necesario para quemar los combustibles fósiles y obtener así energía, y se requiere durante el metabolismo urbano para quemar carbohidratos. en ambos procesos, los productos secundarios son dióxido de carbono y agua. El oxigeno constituye
el 21 % en volumen del aire y el 49.5 % en peso de la corteza terrestre. La otro forma alotrópica del oxigeno es el ozono, cuya fórmula es o3 es mas reactivo que el oxigeno ordinario y se puede formar a partir de oxigeno en un arco eléctrico, como el descargador a distancia de un motor eléctrico, también
se puede producir ozono por la acción de la luz ultravioleta sobre el oxigeno; esto explica el aroma " fresco del aire durante las tormentas eléctricas".
- Azufre: El azufre es el segundo elemento no metal del grupo. a temperatura ambiente es un sólido amarillo pálido que se encuentra libre en la naturaleza. lo conocían los antiguos y se le menciona en el libro del génesis como piedra de azufre. las moléculas de azufre contienen ocho átomos de azufre
conectados a un anillo; su fórmula es s8 . el azufre tiene una importancia especial en la manufactura de neumáticos de hule y acido sulfúrico, H2SO4 . Otros compuestos de azufre son importantes para blanquear frutos y granos Se usa en muchos procesos industriales como la producción de ácido sulfúrico (sustancia química más importante a nivel industrial), en la fabricación de pólvora y el vulcanizado del caucho. Algunos compuestos como los sulfitos tienen propiedades blanqueadoras, otros tienen uso medicinal (sulfas, sulfato de magnesio). También se utiliza en la elaboración de fertilizantes y como fungicida.
-Selenio: El selenio es un no metal que presenta interesantes propiedades y usos. la conductividad de este elemento aumenta con la intensidad de la luz. a causa de esta fotoconductividad, el selenio se a utilizado en los medidores de luz para camaras fotograficas y en fotocopiadoras, pero la preocupación que origina su toxicidad ha hecho que disminuya su uso. el selenio tambien puede convertir la corriente electrica alterna en corriente directa; se ha utilizado en rectificadores, como los convertidores que se usan en los radios y grabadores portátiles, y en herramientas electricas recargables. el color rojo que el selenio imparte al vidrio lo hace util en la fabricación de lentes para señales luminosas.
Se utiliza básicamente en electricidad y electrónica, como en células solares y rectificadores. Se añade a los aceros inoxidables y es catalizador de reacciones de deshidrogenación. Algunos compuestos se emplean en la fabricación del vidrio y esmaltes. Los sulfuros se usan en medicina veterinaria y champús. El dióxido de selenio es un catalizador muy utilizado en reacciones de oxidación, hidrogenación y deshidrogenación de compuesos orgánicos.
- Telurio: El telurio, tiene aspecto metalico, pero es un metaloide en el que predominan las propiedades no metalicas. se emplea en semiconductores y para endurecer las placas de los acumuladores de plomo y el hierro colado. se presenta en la naturaleza en diversos compuestos, pero no es abundante. el polonio es un elemento radiactivo poco comun que emite radiación alfa y
gama; su manejo es muy peligroso. los usos de este elemento se relacionan con su radiactividad, y fue descubierto por marie curie, quien le dio este nombre en honor a su natal polonia.
Se emplea para aumentar la resistencia a la tensión en aleaciones de cobre y plomo y en la fabricación de dispositivos termoeléctricos. También se utiliza como agente vulcanizador y en la industria del vidrio. El telurio coloidal es insecticida y fungicida.
- Polonio: los isótopos constituyen una fuente de radiación alfa. Se usan en la investigación nuclear. Otro uso es en dispositivos ionizadores del aire para eliminar la acumulación de cargas electrostáticas.
GRUPO VA DE LA TABLA PERIÓDICA

Los Nitrogenoides o Nitrogenoideos son un grupo de elementos conocido como Grupo VA, Grupo 15 o Grupo del Nitrógeno en la Tabla Periódica de los Elementos.
Estos elementos componen el 0,33% en masa de la corteza terrestre y muy pocas veces se hallan nativos en la naturaleza y generalmente se encuentran en forma de compuestos ya sea óxidos, sulfuros, fosfatos, entre otros. Mediante la reducción de los óxidos con carbono o por calcinación y reducción de los sulfuros, se pueden obtener los mismos.
El único elemento metálico del grupo, el bismuto, está clasificado en la tabla periódica como “otros metales” junto a los metales de los grupos 13 y 14 . Poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np3 (2 electrones s y 3 electrones p), exhibiendo los siguientes estados de oxidación: +3, +5 y -3. A medida que crece el número atómico, prevalecerá el estado de oxidación +3.
Elementos
- Nitrógeno (N)
- Fósforo (P)
- Arsénico (As)
- Antimonio (Sb)
- Bismuto (Bi)
- Unumpentio ( Uup)
Propiedades de los Nitrogenoides
- Poseen la siguiente estructura electrónica en la última capa:
N: 2 s² 2 p³
P: 3 s² 3 p³
As: 4 s² 4 p³
Sb: 5 s² 5 p³
Bi: 6 s² 6 p³
- Son muy reactivos a alta temperatura
-Todos poseen al menos el estado de oxidación -3 debido a la facilidad que tienen de ganar o compartir 3 electrones para alcanzar la configuración del gas noble correspondiente
- También poseen el estado de oxidación + 5 de manera que tienen facilidad para perder 5 electrones y quedarse con la configuración de gas noble del periodo anterior
- En este grupo se acentúa la tendencia de las propiedades no metálicas.
- Tienen tendencia a la polimorfia, es decir, existen variedades alotrópicas con
propiedades físico-químicas muy diferentes:
Fósforo blanco, rojo, negro violeta
Arsénico gris, amarillo...
Antimonio gris, amarillo...
Propiedades físicas
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta a medida que se desciende en el mismo. El nitrógeno es un gas diatómico inerte que forma el 78,1 % en volumen del aire atmosférico. Además es un no metal incoloro. Por su parte, el fósforo es un no metal sólido de color blanco, pero puro es incoloro. En sus formas alotrópicas presentan diferentes coloraciones y propiedades. Los más comunes son el fósforo blanco el más tóxico e inflamable, el fósforo rojo es mucho más estable y menos volátil y por último el fósforo negro, el cual presenta una estructura similar al grafito y conduce la electricidad. Además es más denso que las otras dos formas y no se inflama.
Elementos del grupo 15
Los metaloides o semimetales de este grupo son el arsénico y antimonio. Estos elementos se asemejan a los metales en sus propiedades físicas, pero se comportan químicamente como un no metal. El arsénico es metaloide sólido y tóxico de color gris metálico que presenta tres formas alotrópicas:
- El arsénico gris metálico: es la forma más estable de las tres y es un buenconductor del calor pero bastante malo conductor de electricidad.
- El arsénico amarillo: Es enormemente volátil y más reactivo que el arsénico gris metálico y manifiesta fosforescencia a temperatura ambiente.
- El arsénico negro: Presenta propiedades intermedias entre las formas
anteriores.
De igual manera, el antimonio es un semimetal que en su forma elemental es un sólido cristalino de color blanco plateado, fundible, frágil, con una escasa conductividad de calor y electricidad que se evapora a bajas temperaturas. Este metaloide presenta cuatro formas alotrópicas:
- Antimonio puro gris plateado
- Antimonio blanco azulado: es su forma más estable y metálica
- Antimonio negro: Inestable y no metálico
- Antimonio amarillo: Inestable y no metálico
El elemento metálico de este grupo es el bismuto, el cual es cristalino, blanco grisáceo, lustroso, duro y quebradizo. Es uno de los pocos metales que se expanden al solidificarse. Su conductividad térmica es menor que la de cualquier otro metal, con excepción del mercurio.
De manera resumida, las propiedades metálicas de este grupo van incrementando a medida que se desciende en la tabla periódica, desde el nitrógeno al bismuto. Por lo que ocurre una disminución de los puntos de fusión a partir del arsénico, ya que disminuye el carácter covalente de los enlaces y aumenta el carácter metálico.
Propiedades químicas
Los elementos del grupo 15 poseen algunas propiedades químicas similares, entre estas tenemos:
- Son muy reactivos a altas temperaturas
- No reaccionan con el agua
- No reaccionan con ácidos no oxidantes
- Reaccionan con ácidos oxidantes a excepción del nitrógeno.
- Forman óxidos con número de oxidación +3 y +5, a excepción del nitrógeno que forma óxidos entre los rango +1 y +5.
- Los hidróxidos que forman disminuyen su acidez a medida que se desciende en el grupo, siendo básico el hidróxido de bismuto (III).
- El bismuto reacciona con el oxígeno y con halógenos, produciendo bismita y bismutina entre otros compuestos.
Aplicaciones
- Nitrógeno (N): El nitrógeno es un gas diatónico que presenta una gran cantidad de aplicaciones
industriales.
El gas nitrógeno se emplea usualmente en la parte superior de los explosivos líquidos para evitar que estallen. En menor escala se utiliza para inflar los neumáticos o llantas de los aviones y los automóviles. Aunque, en los automóviles comerciales es usual emplear aire normal.
También se pueden inflar neumáticos con nitrógeno gaseoso.
El gas nitrógeno se utiliza como un gas aislador, cuando se seca y se presuriza, para equipos de alta tensión.
El nitrógeno también se emplea en la elaboración de bombillas como una opción más económica en comparación con el gas noble argón.
Entre otros usos del gas nitrógeno tenemos:
-En la fabricación de piezas eléctricas tales como transistores, diodos y circuitos integrados.
En la elaboración de acero inoxidable. Para disminuir el peligro de incendio en los sistemas militares de combustible de aeronaves. Se emplea como una alternativa al dióxido de carbono en la presurización de cerveza. En la industria alimentaria se emplea para conservar los alimentos envasados al interrumpir la oxidación de los mismos. Por ejemplo, para inflar los envoltorios que contienen alimentos, como los de frituras, y así mantenerlos frescos más tiempo. En medicina el nitrógeno es un elemento importante de casi todas las drogas farmacológicas. El óxido nitroso comúnmente llamado “gas de la risa” se utiliza como un anestésico. Por su parte, el nitrógeno en su forma líquida, es usado en gastronomía para cocinar al frío los alimentos.
Con la técnica del nitrógeno líquido se puede acelerar la cocción para descartar los procesos bacterianos y para reducir que las pérdidas de propiedades organolépticas generen un deterioro. También se utiliza en la preparación de helados. El nitrógeno líquido se usa en la preparación de cócteles.
En el campo de la medicina y la biología, se utiliza también el nitrógeno líquido en una técnica llamada criopreservación. Esta técnica consiste en la congelación a muy bajas temperaturas (entre -80 ºC y -196 ºC) de células o tejidos para reducir las funciones vitales de una célula o un organismo y poder conservarlo en ambientes de vida suspendida por mucho tiempo.
Criopreservación de embriones
De igual manera es usado el nitrógeno líquido para enfriar los detectores de rayos X y las unidades centrales de procesamiento en las computadoras cuando están calientes.
Fósforo (P)
-Al igual que el nitrógeno, el fósforo presenta un sinfín de aplicaciones. De hecho el fósforo es un componente importante del ADN y ARN y es un nutriente fundamental para las plantas, por lo cual se agrega a los fertilizantes para su elaboración.
-El fósforo en forma de fosfatos esta presente en el ADN
-El fósforo rojo se emplea en la fabricaciónde cerillos, fósforos de seguridad, cohetes y en la elaboración de acero.
-En su forma alotrópica blanca, es usado en bombas incendiarias, bombas de humo y en munición trazadora.
 -Los isótopos radiactivos de fósforo son utilizados en laboratorios como trazadores radiactivos para ayudar a comprender las reacciones e interacciones químicas.
-Los isótopos radiactivos de fósforo son utilizados en laboratorios como trazadores radiactivos para ayudar a comprender las reacciones e interacciones químicas.
-Los compuestos de fósforo también son ampliamente utilizados, por ejemplo los fosfatos se emplean para fabricar un vidrio especial que se usa en las lámparas de sodio.
-El tributilfosfato se emplea el proceso purex para extraer uranio.
-El fosfato de calcio es usado para elaborar porcelana fina.
-El tripolifosfato de sodio se emplea en algunos países como detergentes para ropa. Sin embargo, se ha prohibido en otros países debido a que provoca la muerte de los peces cuando pasa hacia las vías fluviales.
-Detergentes con fosfato
-Otros compuestos de fósforo son empleados en la elaboración de pesticidas, fertilizantes, aditivos alimentarios y pasta dentales.
Arsénico (As)
El arsénico en su forma metálica es usado en aleaciones con cobre y plomo en la fabricación de baterías para automóviles, ya que le proporciona dureza y fortalecimiento a la misma. También se emplea en la industria electrónica en dispositivos semiconductores para elaborar láseres.


Otro tipo de aleación es mezclado en pequeñas cantidades con el alfa latón para que sea más duro y resistente a la lixiviación de zinc. El alfa latón se emplea para elaborar piezas de tuberías u otros artículos que están en contacto constante con el agua.
Este metaloide es ampliamente usado en la fabricación de pesticidas, herbicidas e
insecticidas, aunque actualmente se ha estado prohibiendo por su alta toxicidad.
Pesticidas, herbicidas e insecticidas Debido a su toxicidad, es usado como conservante de madera y así evitar el contacto con insectos, bacterias y hongos.
El arsénico se usa como conservante de madera En medicina fue usado en el tratamiento de algunas enfermedades como la sífilis, mucho antes del descubrimiento de la penicilina. Actualmente es utilizado como aditivo en pequeñas cantidades en los alimentos de animales para prevenir enfermedades y ayudar a su desarrollo. También se emplea en el tratamiento de un tipo de cáncer llamado leucemia promielocítica aguda. Así mismo es empleado en la preparación de soluciones médicas de Fowler para el tratamiento de la psoriasis. Por su parte, el isótopo arsénico-74 usa como una manera de ubicar tumores en el cuerpo. De hecho se origina imágenes más claras que empleando yodo.
Antimonio (Sb)
El antimonio al igual que el arsénico, es ampliamente utilizado en la electrónica como semiconductor en la fabricación de láseres, dispositivos de efecto Hall y detectores infrarrojos.
Láser También es usado en aleaciones con otros elementos como por ejemplo, con estaño para obtener un metal antifricción; igualmente en el peltre, metal inglés, entre otros. De igual manera, se alea con el plomo para fabricar baterías y acumuladores para así proporcionar resistencia a la corrosión y dureza. Esta misma aleación es utilizada para elaborar piezas de imprenta.

Baterías de automóviles.
Los compuestos de antimonio poseen una gran cantidad de aplicaciones industriales, dentro de los cuales se pueden nombrar:
-El trifluoruro de antimonio se utiliza para la fluoración.
-El pentacloruro de antimonio se emplea en la cloración.
-El tricloruro de antimonio se aprovecha como un catalizador para reacciones de polimerización, craqueo y en la cloración. También es un reactivo utilizado en la prueba de Carr-Price para determinar la vitamina A y otros carotenoides.
-El óxido de antimonio III es usado como retardante de la llama de plásticos, catalizador para fibras plásticas, pigmentos, fritas cerámicas y ciertos minerales.
-El doble tartrato de antimonio y potasio se utiliza en el campo de la medicina
-El sulfuro de antimonio rojo se emplea en equipos de seguridad y en el vulcanizado del caucho.
-El isótopo radiactivo Sb-124 se utiliza como trazador en los oleoductos. La mezcla de óxido y sulfuro de antimonio se usa como tinte amarillo para el vidrio y la cerámica
Bismuto (Bi)
 Este metal es usado en aleaciones debido a que presentan baja temperatura de fusión por lo cual lo hace idóneo para ser empleado abundantemente en la detección de incendios y dispositivos de supresión del sistema de seguridad. Sus aleaciones también son usadas en esmaltes cerámicos, plomadas de pesca, aparatos de procesamiento de alimentos, en plomería, soldaduras, entre otros.
Este metal es usado en aleaciones debido a que presentan baja temperatura de fusión por lo cual lo hace idóneo para ser empleado abundantemente en la detección de incendios y dispositivos de supresión del sistema de seguridad. Sus aleaciones también son usadas en esmaltes cerámicos, plomadas de pesca, aparatos de procesamiento de alimentos, en plomería, soldaduras, entre otros.
Las aleaciones de bismuto han tenido un auge comercial importante ya que se emplea como reemplazo del tóxico plomo.
Los compuestos de bismuto poseen una variedad de usos en cosméticos, por ejemplo el oxicloruro de bismuto, usualmente es empleado como pigmento en sombras de ojos, espray para el cabello y esmalte para uñas. También es usado para tratar la diarrea y la acidez estomacal.
GRUPO IVA DE LA TABLA PERIÓDICA

Propiedades
Los elementos del grupo IVA son: carbono(C), silicio(si), germanio(ge), estaño(Sn),plomo(Pb), erristeneo(Eo). Estos elementos forman más de la cuarta parte de la corteza terrestre y solo podemos encontrar en forma natural al carbono al estaño y al plomo en forma de óxidos y sulfuros, su configuración electrónica termina en ns2,p2.
Los elementos de este grupo presenta diferentes estados de oxidación y estos son: +2 y +4., los compuestos orgánicos presentan variedad en su oxidación Mientras que los óxidos de carbono y silicio son ácidos, los del estaño y plomo son anfótero, el plomo es un elemento tóxico. Estos elementos no suelen reaccionar con el agua, los ácidos reaccionan con el germanio, estaño y plomo, las bases fuertes atacan a los elementos de este grupo, con la excepción del carbono, desprendiendo hidrógeno, reaccionan con el oxígeno formando óxidos.
En este grupo encontramos variedad en cuanto a sus características físicas y químicas a continuación un breve resumen de cada uno de los elementos de este grupo.
Carbono (C)
Es un elemento químico de número atómico 6, es un sólido a temperatura ambiente. Es el pilar básico de la química orgánica; se conocen cerca de 16 millones de compuestos de carbono, aumentando este número en unos 500.000 compuestos por año, y forma parte de todos los seres vivos conocidos. Forma el 0,2 % de la corteza terrestre.
-Características
El carbono es un elemento que posee formas alotrópicas, un caso fascinante lo encontramos en el grafito y en el diamante, el primero corresponde a uno de las sustancias más blandas y el segundo a uno de los elementos más duros y otro caso con el carbón y el diamante, el carbón es tienen un precio comercial bastante bajo en cambio el diamante es conocido por ser una de las piedras mas costosas del mundo. Presenta una gran afinidad para enlazarse químicamente con otros átomos pequeños, incluyendo otros átomos de carbono con los que puede formar largas cadenas, y su pequeño radio atómico le permite formar enlaces múltiples. Así, con el oxígeno forma el dióxido de carbono, vital para el crecimiento de las plantas, con el hidrógeno forma numerosos compuestos denominados genéricamente hidrocarburos.
Estados alotrópicos
Se conocen cinco formas alotrópicas del carbono, una de las formas como encontramos el carbono es el grafito el grafito tienen exactamente la misma cantidad de átomos que el diamante la única variación que este presenta esta en la estructura la estructura del diamante es tetraédrica y la del grafito es mucho más sencilla. Pero por estar dispuestos en diferente forma, su textura, fuerza y color son diferentes.
Silicio (Si)
Es un metaloide de numero atómico 14 de grupo A4. El silicio es el segundo elemento más abundante de la corteza terrestre (27,7% en peso) Se presenta en forma amorfa y cristalizada; el primero es un polvo parduzco, más activo que la variante cristalina, que se presenta en octaedros de color azul grisáceo y brillo metálico.
Características
En forma cristalina es muy duro y poco soluble y presenta un brillo metálico y color grisáceo. Aunque es un elemento relativamente inerte y resiste la acción de la mayoría de los ácidos, reacciona con los halógenos y álcalis diluidos. El silicio transmite más del 95% de las longitudes de onda de la radiación infrarroja.
Se prepara en forma de polvo amarillo pardo o de cristales negros-grisáceos. Se obtiene calentando sílice, o dióxido de silicio (SiO2), El silicio cristalino tiene una dureza de 7, suficiente para rayar el vidrio, de dureza de 5 a 7. El silicio tiene un punto de fusión de 1.411 °C, un punto de ebullición de 2.355 °C y una densidad relativa de 2,33(g/ml). Su masa atómica es 28,086 u
Estados del silicio
El silicio lo podemos encontrar en diversas formas en polvo, policristal ver y olivino
Aplicaciones
Se utiliza en aleaciones, en la preparación de las siliconas, en la industria de la cerámica técnica y, debido a que es un material semiconductor muy abundante, tiene un interés especial en la industria electrónica y microelectrónica como material básico para la creación de obleas o chips que se pueden implantar en transistores, pilas solares y una gran variedad de circuitos electrónicos. El silicio es un elemento vital en numerosas industrias.
Germanio (Ge)
Elemento químico, metálico, gris plata, quebradizo, símbolo Ge, número atómico 32, peso atómico 72.59, punto de fusión 937.4ºC (1719ºF) y punto de ebullición 2830ºC (5130ºF), con propiedades entre el silicio y estaño. El germanio se encuentra muy distribuido en la corteza terrestre con una abundancia de 6.7 partes por millon (ppm). El germanio tiene una apariencia metálica, pero exhibe las propiedades físicas y químicas de un metal sólo en condiciones especiales, dado que está localizado en la tabla periódica en donde ocurre la transición de metales a no metales.
Características
Es un metaloide sólido duro, cristalino, de color blanco grisáceo lustroso, quebradizo, que conserva el brillo a temperaturas ordinarias. Presenta la misma estructura cristalina que el diamante y resiste a los ácidos y álcalis.
Forma gran número de compuestos organometálicos y es un importante materialsemiconductor utilizado en transistores y fotodetectores. A diferencia de la mayoría de semiconductores, el germanio tiene una pequeña banda prohibida (band gap) por lo que responde de forma eficaz a la radiación infrarroja y puede usarse en amplificadores de baja intensidad.
Aplicaciones
Las aplicaciones del germanio se ven limitadas por su elevado costo y en muchos casos se investiga su sustitución por materiales más económicos Fibra óptica. Electrónica: radares y amplificadores de guitarras eléctricas usados por músicos nostálgicos del sonido de la primera época del rock and roll; aleaciones SiGe en circuitos integrados de alta velocidad. También se utilizan compuestos sándwich
Si/Ge para aumentar la movilidad de los electrones en el silicio (streched silicon).Óptica de infrarrojos: Espectroscopios, sistemas de visión nocturna y otros equipos. Lentes, con alto índice de refracción, de ángulo ancho y para microscopios. En joyería se usa la aleación Au con 12% de germanio.
Estaño (Sn)
El estaño se conoce desde antiguo: en Mesopotamia se hacían armas de bronce, Plinio menciona una aleación de estaño y plomo, los romanos recubrían con estaño el interior de recipientes de cobre. Representa el 0,00023% en peso de la corteza. Raramente se encuentra nativo, siendo su principal mineral la casiterita (SnO2). También tiene importancia la estannita o pirita de estaño. La casiterita se muele y enriquece en SnO2 por flotación, éste se tuesta y se calienta con coque en un horno, con lo que se obtiene el metal. Para purificarlo (sobre todo de hierro) se eliminan las impurezas subiendo un poco por encima de la temperatura de fusión del estaño, con lo que éste sale en forma líquida.
Características
Es un metal, maleable, que no se oxida y es resistente a la corrosión. Se encuentra en muchas aleaciones y se usa para recubrir otros metales protegiéndolos de la corrosión. Una de sus características más llamativas es que bajo determinadas condiciones forma la peste del estaño.
Formas alotrópicas
El estaño puro tiene dos variantes alotrópicas: El estaño gris, polvo no metálico, conductor, de estructura cúbica y estable a temperaturas inferiores a 13,2 °C, que es muy frágil y tiene un peso específico más bajo que el blanco
Aplicaciones:
Se usa como revestimiento protector del cobre, del hierro y de diversos metales usados en la fabricación de latas de conserva. También se usa para disminuir la fragilidad del vidrio. Los compuestos de estaño se usan para fungicidas, tintes, dentífricos (SnF2) y pigmentos. Se usa para hacer bronce, aleación de estaño y cobre. Se usa para la soldadura blanda, aleado con plomo. Se usa en aleación con plomo para fabricar la lámina de los tubos de los órganos musicales. En etiquetas. Recubrimiento de acero. Se usa como material de aporte en soldadura blanda con cautín, bien puro o acerado. La directiva RoHS prohíbe el uso de plomo en la soldadura de determinados aparatos eléctricos y electrónicos. El estaño también se utiliza en la industria de la cerámica para la fabricación de los esmaltes cerámicos. Su función es la siguiente: en baja y en alta es un o pacificante. En alta la proporción del porcentaje es más alto que en baja temperatura.
Plomo (Pb)
Es un elemento de la tabla periódica, cuyo símbolo es Pb y su número atómico es 82 Dmitri Mendeléyev químico no lo reconocía como un elemento metálico común por su gran elasticidad molecular. Cabe destacar que la elasticidad de este elemento depende de las temperaturas del ambiente, las cuales distienden sus átomos, o los extienden. El plomo es un metal de densidad relativa 11,45 a 16 °C tiene una plateada con tono azulado, que se empaña para adquirir un color gris mate. Es flexible, in-elástico y se funde con facilidad. Su fusión se produce a 326,4 °C y hierve a 1745 °C. Las valencias químicas normales son 2 y 4.
Aplicaciones
El plomo se usa como cubierta para cables, ya sea la de teléfono, de televisión, de Internet o de electricidad, sigue siendo una forma de empleo adecuada. La ductilidad única del plomo lo hace particularmente apropiado para esta aplicación, porque puede estirarse para formar un forro continuo alrededor de los conductores internos. Se utilizan una gran variedad de compuestos de plomo, como los silicatos, los carbonatos y sales de ácidos orgánicos, como estabilizadores contra el calor y la luz para los plásticos de cloruro de polivinilo. Se usan silicatos de plomo para la fabricación de frituras (esmaltes) de vidrio y de cerámica, las que resultan útiles para introducir plomo en los acabados del vidrio y de la cerámica. La asida de plomo, Pb(N3)2, es el detonador estándar para los explosivos plásticos como el C-4. Los arseniatos de plomo se emplean en grandes cantidades como insecticidas para la protección de los cultivos y para ahuyentar insectos molestos como lo son cucarachas, mosquitos y otros animales que posean un exoesqueleto. El litargirio (óxido de plomo) se emplea mucho para mejorar las propiedades magnéticas de los imanes de cerámica de ferrita de bario.

webgrafias:
http://elementos.org.es/astato
https://es.wikipedia.org/wiki/Ox%C3%ADgeno#Caracter.C3.ADsticas
http://www.fullquimica.com/2011/11/tabla-periodica-grupo-viia-halogenos.html
http://es.slideshare.net/Akasuna89/familia-vi-a
http://elementos.org.es/nitrogeno






MEJORAR LA PRESENTACIÓN 4.3
ResponderEliminarBuuuui
EliminarSe merece 10
ResponderEliminar<3
ResponderEliminar